
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способи добування двоосновних карбонових кислот
Для одержання двоосновних кислот використовують принципово такі самі методи, що й для одноосновних, із тією різницею, що в молекулі необхідно одержати не одну, а дві карбоксильні групи: окиснення діолів, гідроліз динітрилів, окиснення оксикислот із первинною спиртовою групою тощо. Наприклад, окисненням етиленгліколю добувають щавлеву кислоту:

|
3. Фізичні та хімічні властивості кислот
Дикарбонові кислоти — безбарвні кристалічні речовини, розчинні у воді. Взаємний вплив карбоксильних груп обумовлює посилення кислотних властивостей сполук. Це пояснюється сильною електроноакцепторною дією однієї карбоксильної групи на другу, яка полегшує дисоціацію О-Н-звязку. Ступінь дисоціації першої стадії вищий за ступінь дисоціації другої стадії, особливо для щавлевої і малонової кислот:

| ||
| щавлева | 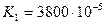
| 
|
| малонова | 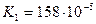
| 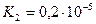
|
| бурштинова | 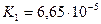
| 
|
Двоосновні кислоти вступають в усі хімічні реакції, характерні для одноосновних кислот: утворення солей, естерів, ангідридів, галогенангідридів та ін., як за однією, так і за двома карбоксильними групами.
Крім того, двоосновні кислоти виявляють і специфічні властивості, які зумовлені відстанню між карбоксильними групами. Кислоти, в яких карбоксильні групи знаходяться поруч (положення 1,2 — щавлева кислота) або через атом Карбону (положення 1,3 — малонова кислота і її похідні) за умов нагрівання до 150-170°С розкладаються з відщепленням карбон(IV) оксиду й утворенням одноосновних кислот:

| |
| щавлева кислота | мурашина кислота |

| |
| малонова кислота | оцтова кислота |
Дикарбонові кислоти з 1,4 і 1,5 положеннями карбоксильних груп (бурштинова і глутарова) за умов нагрівання до 300°С відщеплюють воду й утворюють циклічні ангідриди:

| |
| бурштинова кислота | бурштиновий ангідрид |
4. Окремі представники двоосновних карбонових кислот, їх значення і використання
Щавлева (етандіова) кислота — безбарвна кристалічна речовина існує у вигляді кристалогідрату 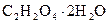 . Щавлева кислота зустрічається у природі як у вільному стані, так й у вигляді оксалатів. Її кислі калієві солі у невеликих кількостях містяться у щавлі, кислицях, смородині, малині, апельсинах. Оксалати кальцію зустрічаються в усіх рослинах. Із порушенням обміну речовин вони можуть відкладатись в організмі людини у печінці, нирках у вигляді каміння.
. Щавлева кислота зустрічається у природі як у вільному стані, так й у вигляді оксалатів. Її кислі калієві солі у невеликих кількостях містяться у щавлі, кислицях, смородині, малині, апельсинах. Оксалати кальцію зустрічаються в усіх рослинах. Із порушенням обміну речовин вони можуть відкладатись в організмі людини у печінці, нирках у вигляді каміння.
Малонова (пропандіова) кислота — безбарвна кристалічна речовина, знаходиться в буряковому соку. Вперше була добута окисненням яблучної кислоти  .
.
Бурштинова (бутандіова) кислота міститься в недозрілих фруктах, ягодах (смородині, чорниці, крижовнику, винограді), в багатьох рослинах, бурому вугіллі, янтарі. Вперше була добута перегонкою янтарю. Легко втрачає воду і утворює циклічний ангідрид.
Адипінова (гександіова) кислота — безбарвна кристалічна речовина, обмежено розчинна у воді. Міститься в буряковому соку. Широко використовується в техніці — у виробництві синтетичних смол, для синтезу пластифікаторів, найлону. У харчовій промисловості застосовується як замінник винної і лимонної кислот.
5. Ароматичні і ненасичені двоосновні кислоти: основні властивості і використання.
Добування фталевих кислот: окиснення відповідних заміщених похідних бензолу.
Фталеві кислоти виявляють типові властивості карбонових кислот: утворення солей, естерів, амідів та інших похідних і вступають у багато інших реакцій, характерних для дизаміщених бензолу. Ангідрид дає тільки фталева кислота. Фталева кислота (о -ізомер) і її похідні мають важливе промислове значення.
Поліконденсацією фталевого ангідриду і гліцерину одержують смоли, відомі під назвою гліфталеві або алкідні смоли. Діестери фталевої кислоти використовуються як репеленти, пластифікатори для пластмас та ін.
Фталевий ангідрид є напівпродуктом у виробництві деяких синтетичних барвників та вітамінів. Зокрема, нагрівання суміші фталевого ангідриду з фенолом у присутності сульфатної (сірчаної) кислоти (водовіднімаючий засіб) відбувається з утворенням фенолфталеїну, який використовуються як індикатор.
Терефталева кислота (n -ізомер) використовується у виробництві
поліетилен-терефталату — сировини для виготовлення волокна лавсану.
Змістовий модуль 3 Гетерофункціональні сполуки
|
|
Дата добавления: 2014-12-08; Просмотров: 3444; Нарушение авторских прав?; Мы поможем в написании вашей работы!