
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способи добування оксикислот
|
|
|
|
План
1. Класифікація, ізомерія, номенклатура гідроксикислот.
2. Способи добування гідроксикислот.
3. Фізичні властивості гідроксикислот.
4. Хімічні властивості гідроксикислот.
5. Окремі представники.
Ключові слова: гідроксикислота, оптична ізомерія, поляризація світла, кут питомого обертання, оптична активність, асиметричний (хіральний) атом Карбону, проекційні формули Фішера, рацемічна суміш, оптичні антиподи(енантіомери), молочна кислота, ціангідринний синтез, лактид, лактон.
Література: [2] с. 13 - 33; [3] с. 420 – 432
1. Класифікація, ізомерія, номенклатура гідроксикислот
Гідроксикислоти — органічні сполуки, молекули яких містять дві функціональні групи: карбоксильну та гідроксильну. Залежно від кількості карбоксильних груп розрізняють одно-, двох- та багатоосновні кислоти, а від кількості гідроксогруп (включаючи гідроксогрупу, яка входить до складу карбоксильної групи) — двох-, трьох- та багатоатомні оксикислоти.
За будовою вуглеводневого радикалу, з яким зв’язані окси- і карбоксильні групи, оксикислоти поділяють на аліфатичні (насичені і ненасичені), ароматичні, гетероциклічні.
Для назв оксикислот широко використовують тривіальні назви, а також но-менклатуру ІUPAC та раціональну.
Номенклатура гідроксикислот:
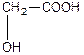
| Оксиоцтова, 2-гідроксиетанва або гліколева кислота (одноосновна, двоатомна) | |
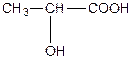
| a -оксипропіонова, 2-гідроксипропанова кислота або молочна (одноосновна, двоатомна). | |
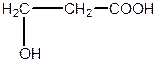
| b -оксипропіонова, 3-гідроксипропанова кислота (одноосновна, двоатомна) | |

| Монооксиянтарна, 2-гідроксибутандіова або яблучна кислота (двоосновна, триатомна) | |
Ізомерія оксикислот залежить від будови карбонового скелету та положення функціональних груп.
|
|
|
Крім структурної ізомерії для оксикислоти характерна оптична ізомерія.
Способи добування: гідроліз a -галогензаміщених карбонових кислот; гідратація ненасичених кислот; ціангідринний синтез; окиснення діолів; відновлення оксокислот тощо.
4. Фізичні властивості гідроксикислот
Уявлення про поляризацію світла, площину поляризації, величину кута обертання. Схема будови поляриметра. Питоме обертання. Молярне обертання.
Оптична активність - здатність речовин обертати площину поляризації променю поляризованого світла. Речовини, які мають такі властивості є оптично-активними речовинами.
Здатність обертання площини поляризації світла пов’язана з асиметрією в просторовій будові молекул оптично активних речовин. Якщо в молекулі речовини є хоч один атом Карбону, який з’єднаний із чотирма різними атомами або групами, то такі молекули асиметричні, тобто не мають площини симетрії. Це є причиною оптичної активності речовин.
Атоми Карбону, що з’єднані з чотирма різними атомами або групами атомів називають асиметричними (хіральними) атомами Карбону. Асиметричний атом Карбону в формулі молекули позначається зірочкою.
Уявлення про оптичні ізомери, рацемічну суміш. Оптичні ізомери відрізняються різним розташуванням атомів або груп атомів у просторі навколо асиметричного атому Карбону. Їх кількість (N) дорівнює 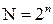 , де n- кількість асиметричних атомів Карбону в молекулі.
, де n- кількість асиметричних атомів Карбону в молекулі.
Оптичні антиподи (дзеркальними ізомерами або енантіомерами) - це оптичні ізомери, які подібні між собою як предмет і його дзеркальне відображення. Вони виявляють однакові фізичні, хімічні властивості, але різну фізіологічну дію.
Для просторового відображення оптичних ізомерів, крім тетраедричних моделей, широко використовуються проекційні формули Фішера.
Розглянемо оптичні ізомери на прикладі молочної кислоти:
|
|
|
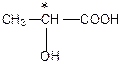
|
Між кількістю асиметричних атомів Карбону в молекулі (n) і кількістю оптичних ізомерів (N) існує певна залежність: 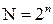 .
.
У молочній кислоті один асиметричний атом Карбону, тому її молекула існує у вигляді двох оптичних ізомерів:
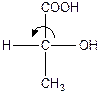
| 
|
Ці ізомери обертають площину поляризованого світла на один і той же кут, але один ліворуч (-), а другий праворуч (+).
Суміш однакової кількості ліво- і правообертаючих ізомерів — рацемічна суміш, або рацемат, оптично неактивна і позначається dl або r.
Оптичні ізомери розрізняють не тільки за напрямком обертання, але й за конфігурацією, тобто за розташуванням замісників навколо останнього асиметричного атому Карбону, відносячи їх до D- або L-ряду. Оптично активні сполуки, в молекулах яких гідроксогрупа –OH біля останнього асиметричного атому Карбону розміщується праворуч, відносять до D-ряду, і відповідно, речовини, в молекулах яких вона розміщена ліворуч — до L-ряду.
5. Хімічні властивості гідроксикислот
Хімічні властивості гідроксикислот обумовлені наявністю карбоксильної та гідроксильної груп. Також характерні реакції, що обумовлені взаємний впливом цих функціональних груп.
Специфічні реакції оксикислот
До таких реакцій, які дозволяють розрізняти a-, b-, g-, d -оксикислоти, відносяться реакції, що перебігають із виділенням води в умовах нагрівання.
a - Оксикислоти за умов нагрівання, втрачаючи дві молекули води, утворюють міжмолекулярні циклічні естери - лактиди.
b-Оксикислоти дуже легко відщеплюють воду, утворюючи етиленовий зв’язок (a-, b -ненасичені кислоти).
g- і d-оксикислоти відщеплюють воду від однієї молекули кислоти і утворюють сполуки, які називають лактонами.
Характерною реакцією тільки для a -оксикислот є розклад їх за умов нагрівання з мінеральними кислотами:
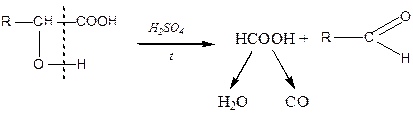
|
У результаті утворюється альдегід (або кетон) і мурашина кислота.
6. Окремі представники
Гліколева, молочна (a -оксипропіонова), b -оксимасляна, рицинолева кислоти. Яблучна, винна кислоти. Реактив Фелінга. Лимонна кислота і її розклад за умов нагрівання в присутності сульфатної кислоти. Мигдальна кислота.
Фенолокислоти — похідні ароматичних кислот, в яких атом Гідрогену в бензольному ядрі заміщено на гідроксогрупу. Саліцилова кислота виявляє антисептичні (консервуючі), протиревматичні та жарознижуючі властивості. Подібні властивості характерні і похідним саліцилової кислоти: натрій саліцилату (сіль), ацетилсаліциловій кислоті (естер)— аспірину.
|
|
|
Галова кислота. Танін, уявлення про дубільні речовини.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 2652; Нарушение авторских прав?; Мы поможем в написании вашей работы!