
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фізичні властивості білків
 |
План
ВЛАСТИВОСТІ БІЛКІВ
Способи добування білків
У зв'язку з широким застосуванням білково-пептидних препаратів у медицині, сільському господарстві, харчовій промисловості проблема штучного синтезу пептидів і білків має велике наукове та практичне значення. Вперше пептидний синтез був здійснений видатним німецьким хіміком Е. Фішером, який в 1901 р. отримав гліцилгліцин, а в 1903 р. запропонував хлорангідридний спосіб утворення пептидів.
Усі методи хімічного синтезу пептидів та білків грунтуються на послідовному здійсненні трьох стадій (Ю. А. Овчинников, 1987): а) блокуванні (захисті) функціональних груп амінокислоти або пептиду, що не беруть участі в реакції утворення пептидного зв'язку; б) конденсації активованої карбоксильної групи одного реакційного компонента з аміногрупою іншого компонента; в) видаленні захисних груп для отримання вільного пептиду (кінцевого продукту) або продовження синтезу.
Важливим внеском у проблему штучного синтезу пептидів та білків став запропонований Р. Мерифілдом метод твердофазного синтезу. Головна ідея цього методу полягає в закріпленні поліпептидного ланцюга, що утворюється, на полімерному нерозчинному носії, поверхня якого містить хлорметильні "якірні" групи. За допомогою розробленого методу Р. Мерифілд здійснив синтез пептидів брадикініну, ангіотензину та перший штучний синтез ферментного білка — рибонуклеази. В методі рідкофазового синтезу пептидів (за М. М. Шемякіним, 1965) як носій, на поверхні якого відбувається синтез, застосовують розчинний полістирол, що дає змогу збільшити швидкість реакцій синтезу.
Лекція 23 (2 години)
1.Фізичні властивості білків
2. Хімічні властивості білків.
|
|
|
3. Значення білків і їх використання.
Ключові слова: 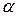 -амінокислота, білки, діаліз, ізоелектричний стан білків, амфотерність, гідратація, дегідратація, денатурація, ферментативна активність, біуретова реакція, ксантопротеїнова реакція, сультфгідрильна реакція, штучні волокна.
-амінокислота, білки, діаліз, ізоелектричний стан білків, амфотерність, гідратація, дегідратація, денатурація, ферментативна активність, біуретова реакція, ксантопротеїнова реакція, сультфгідрильна реакція, штучні волокна.
Література: [2] с. 140 - 143; [3] с. 484-485
Агрегатний стан. Природні білкові речовини різноманітні за агрегатним станом: зустрічаються рідкі, напіврідкі, тверді. Та більшість білків, виділених із природних об’єктів, мають вигляд безбарвних аморфних порошків.
Розчинність. Білки здебільшого розчинні у воді, кислотах, лугах, але нерозчинні в органічних розчинниках. У розчинах існують у вигляді гідрофільних колоїдів і виявляють багато властивостей колоїдних розчинів. Природні білки оптично активні: вони є лівообертаючими, незалежно від напряму обертання складових амінокислот.
Електрофоретична рухливість білків – при наявності заряду на білкових молекулах вони можуть рухатися в електричному полі до протилежно зарядженого полюсу. У кислому середовищі сумарний заряд білкової молекули позитивний, тому вона рухається до катоду (-). У лужному середовищі сумарний заряд білкової молекули негативний, тому вона рухається до аноду(+). При значенні рН, що відповідає ізоелектричній точці, білок не рухається в електричному полі.
Високомолекулярність білкових молекул – полімери, які складаються із великої кількості мономерів (α-амінокислот), і мають молекулярну масу від 6000 до декількох мільйонів.
Діаліз – переміщення речовин через напівпроникну мембрану, яка пропускає маленькі і затримує великі молекули.
Колоїдний характер водних розчинів білка – обумовлюється високомолекулярністю і великим діаметром білкових молекул (> 0,001 мкм; 1 мкм = 10-6м). Протоплазма, яка у великій мірі складається з води і білків, є колоїдною системою. Молекули колоїдного розчину одного білка мають однаковий заряд і тому відштовхуються, не з’єднуються у великі агрегати і не осаджуються. Вони повільно дифундують, не здатні проникати через напівпроникні мембрани, розсіюють світло, мають велику в’язкість.
|
|
|
Гелі (драглі) – за певних умов усі колоїдні розчини можуть втрачати текучість і утворювати гелі (драглі). Вони виникають у результаті об’єднання молекул у вигляді сітки, внутрішній простір якої заповнений великою кількістю розчинника, але при цьому розділення на рідку і тверду фази не відбувається, як у випадку коагуляції.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 6358; Нарушение авторских прав?; Мы поможем в написании вашей работы!