
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Природные алкалоиды
|
|
|
|
Ферментативное разделение. Биохимическое получение оптически активных веществ.
Впервые этот метод был использован Пастером в 1857 году случайно. Грибок плесени Penicillium glaucum разрушает природную (+)-винную кислоту, а её энантиомер − (−)-винную кислоту, не встречающуюся в природе оставляет нетронутой. Таким образом, при скармливании рацемической смеси получают чистый энантиомер левовращающей винной кислоты.
Биохимический метод основан на том, что микроорганизмы при своем развитии используют только один из двух оптических изомеров, присутствующих в рацемате. Остающийся энантиомер может быть выделен. Этот путь позволяет получать только один из энантиомеров, второй необратимо теряется. Избирательность действия микроорганизмов по отношению к энантиомерам связана с высокой энантиоселективностью содержащихся в микроорганизмах ферментов. Поэтому для разделения энантиомеров нет необходимости применять сами микроорганизмы, достаточно использовать в этих целях выделенные из биологических объектов ферментные препараты. Наиболее широко для расщепления рацематов применяют гидролазы − ферменты, катализирующие гидролиз сложноэфирных или амидных связей. При этом гидролизу подвергается только один из двух энантиомеров субстрата, а разделение конечной смеси, например, свободной кислоты и ее сложного эфира осуществляется обычными химическими методами. Так, при действии фермента ацилазы на практически любую рацемическую N -ациламинокислоту гидролизу (а, следовательно, и отделению) подвергается лишь L -форма.
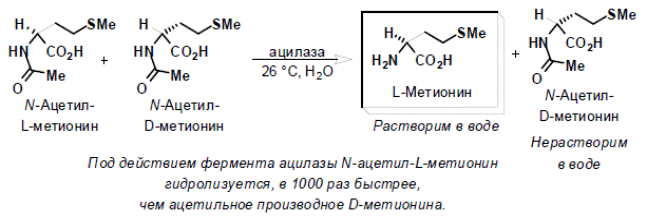
Примеры. В промышленности биохимический метод особенно успешно используется для получения оптически активных аминокислот с использованием иммобилизованных на нерастворимом носителе ферментов. Под действием фермента ацилазы N -ацетил- L -метионин гидролизуется, в 1000 раз быстрее, чем ацетильное производное D -метионина. А пекарские дрожжи в процессе брожения перерабатывают преимущественно L -формы аминокислот, а D -антиподы накапливаются и могут быть выделены.
|
|
|
Для разделения рацемических эфиров аминокислот используют их гидролиз под действием ферментов химотрипсина и субтилизина. Гидролизу подвергаются лишь L -энантиомеры.
Сейчас для облегчения работы широко используют ферменты, закреплённые на носителе, иммобилизованные ферменты (например, ацилаза на целлюлозе). В таком виде ферменты более стойки.
Недостатки ферментативных систем.
а) Высокая специфичность действия ферментов ограничивает их использование, поскольку подавляющее большинство синтетических рацематов, не встречается в живой природе, и, следовательно, не подвергается ферментации.
б) Второй недостаток этого метода − относительно высокая стоимость ферментов.
Хинин. Важнейший алкалоид Хинного дерева, цинхоны (Cinchona succirubra) и Ремиджии (emija) семейства мареновых. Растёт в Колумбии, Перу, Боливии, Восточной Африке. В коре содержится до 7.5% по массе хинина. Бесцветные, горькие на вкус кристаллы. Полный синтез 1945 г. Известны все четыре диастереоизомера – все сильные противомалярийные средства. Самый важный - хинидин отличается конфигурацией C9: б/ц кристаллы, т.пл. 173.5 °С, α20D = +334.2 (0.1 H H2SO4), антиаритмическое средство. Гидрохлорид и сульфат природного хинина используют в акушерской практике, усиливает родовую деятельность. Хинидин – диастереоизомер хинина (содержание в коре 0.25-1.25%). До Второй мировой войны хинин был единственным антималярийным препаратом. Когда доставка хинной коры с Явы была прервана войной, были предприняты чрезвычайные меры для получения синтетических антималярийных препаратов. Хинин применяют также для приготовления шипучих тонизирующих напитков. Недавно хинин снова приобрел значение как антималярийный препарат – для лечения устойчивой к хлорохину формы малярии (молниеносной трехдневной малярии).
|
|
|
Хинное дерево благодаря своей коре стало известно европейцам ещё в XVI веке - южноамериканские туземцы издавна лечили ею малярию. По совету испанских иезуитов “красной водой” из хинной коры была излечена от малярии жена вице-короля Перу, графа Луиса Хинхона (отсюда и название). В 1640 г. партия коры “кина-кина” была вывезена в Европу, однако само дерево не было описано ботаникам вплоть до 1737 г. С XVII в. началось активное истребление дикорастущих хинных деревьев ради коры, так что к середине XIX в. возникла опасность их полного исчезновения. При этом правительство Перу препятствовало вывозу посевного материала, чтобы не лишиться монополии на производство хины. Однако Чарльзу Леджеру (Charles Ledger) в 1865 г. удалось купить и вывести семена хинного дерева на Яву, где и была основана первая плантация. В настоящее время хинное дерево распространено во многих тропических странах; основная часть мировой добычи хинной коры приходится на Индонезию. Алкалоиды хинной коры выделяют путем извлечения органическим экстрагентом в щелочной среде. Вытяжку, содержащую сумму алкалоидов-оснований, обрабатывают серной кислотой, при этом выпадает осадок сырого хинина сульфата. Далее выделяют смесь кристаллизующихся алкалоидов цинхонидина, хинидина и цинхонина. После их отделения остается бурая смолистая масса (хиноидин), содержащая смесь аморфных алкалоидов. Из сырого хинина сульфата приготовляют другие легкорастворимые соли: хинина гидрохлорид, хинина дигидрохлорид, хинина сульфат и хинидин.
Сейчас возделывают в основном хинное дерево Леджера (Cinchona ledgeriana, оно же Cinchona calisaya), хинное дерево лекарственное (Cinchona officinalis) и хинное дерево красносоковое (Cinchona succirubra). В России их разводят только в оранжереях ботанических садов. С развитием синтетического производства алкалоидов культура хинного дерева сократилась.
Считается, что хинин из хинной коры впервые был выделен русским профессором Ф. Гизе в Харькове, но его работа не была известна в Европе. В 1820 г. Пьер-Жозеф Пеллетье и Жозеф-Беньямин Каванту во Франции выделили алкалоиды хинин и цинхонин. Полностью структура хинина была установлена в 1907 г., а его синтез осуществлен в 1944 г.
|
|
|
Морфин. C17H19NO3, M 303.37. Один из самых “известных” алкалоидов. Морфин и другие морфиновые алкалоиды встречаются в растениях рода мак, стефания, синомениум, луносемянник. Получают морфин практически только из застывшего млечного сока (опия), выделяющегося при надрезании незрелых коробочек опиумного мака (экстракция разбавленными кислотами). Содержание морфина в сыром опии достигает 10-20 %, минимальные концентрации - около 3 %. Работа с этим оптически активным веществом в химической лаборатории невозможна, это связано с отсутствием препарата в свободной продаже.
Впервые морфин был выделен немецким фармакологом Фридрихом Сертюнером из опиума в 1804 г. Он дал морфину название по имени бога сновидений в греческой мифологии - Морфея, сына Гипноса, бога сна. Морфин был первым алкалоидом, полученным в индивидуальном виде. Широкое распространение морфин получил после изобретения инъекционной иглы в 1853 году. Он используется для купирования боли. Кроме того, его применяли в качестве “лечения” опиумной и алкогольной зависимости. Широкое применение морфина во время Американской гражданской войны, привело к возникновению “армейской болезни” (морфиновой зависимости) у более 400 тысяч человек. В 1874 году из морфина синтезировали диацетилморфин, более известный как героин. Полный синтез морфина осуществлен лишь в 1952 году, но его сложность (около 17 стадий) делает нецелесообразным его коммерческую реализацию. В настоящее время предложено несколько различных методов синтеза, но природный морфин по-прежнему дешевле синтетического.
Стрихнин. Главный индольный алкалоид, М 334.4, C21H22O2N2, содержащийся в семенах одного из видов чилибухи - рвотного ореха (Strychnos nux vomica) семейства логаниевых (Loganiaceae), произрастающих главным образом в тропической Азии и Африке. Белое кристаллическое вещество, имеет чрезвычайно горький вкус. В чилибухе содержание суммы алкалоидов (вместе с бруцином) не менее 2.5%. Открыт в 1818 французскими химиками П. Ж. Пельтье и Ж, Б. Каванту. Структура стрихнина установлена в 1946 Р. Робинсоном, в 1954 Р. Б. Вудворд с сотрудниками осуществил полный синтез стрихнина (около 30 стадий).
|
|
|
Стрихнин высокотоксичный яд, применяется в сельском хозяйстве для истребления грызунов. В лечебных дозах (в медицине применяется азотнокислая соль - нитрат, а также галеновы препараты, получаемые из семян чилибухи). Стрихнин стимулирует рефлекторные функции спинного мозга, повышает возбудимость продолговатого (дыхательный, сосудодвигательный и центр блуждающих нервов) и вышележащих центров головного мозга. В токсических дозах вызывает характерные титанические судороги (опистотонус, “сардоническая улыбка”). В основе действия стрихнина лежит его способность облегчать передачу возбуждения в межнейронных синапсах спинного мозга, преимущественно в области т. н. вставочных нейронов, играющих роль тормозных клеток, уменьшать время рефлекторной реакции в нервных центрах, усиливать распространение возбуждения в спинном мозге.
Бруцин. Индольный алкалоид состава С23Н26N2O4×4H2O, М 394.5 г/моль, белое кристаллическое вещество, плавящееся (в безводном состоянии) при 178°, трудно растворим в воде, но легче, чем стрихнин; не растворяется в эфире и щелочах, но легко - в холодном спирте и хлороформе. Вращает влево плоскость поляризации, вкус горький; ядовит, но менее, нежели стрихнин. Как яд, вызывает судороги шеи, лица, конечностей. Смертельная доза 0.1-0.3 г (перорально, люди). Природный спутник стрихнина, открыт в 1819 г. Пеллетье и Каванту в ненастоящей ангустуровой коре, которую ошибочно считали принадлежащей растению Brucea antidyssenterica, откуда и название вещества: бруцин. Как теперь известно, кора эта доставляется вовсе не Brucea, а одним видом Strychnos, однако прежнее название алкалоида удержалось и доныне. Бруцин (вместе со стрихнином) содержится в семенах плодов рвотного ореха, Strychnos nux vomica (челибуха) ∼ 1-1.5% по массе, в бобах св. Игнатия (Str. St. Ignatii), в Caba longa, южно-американском яде для стрел.
Продажный бруцин содержит от 0.25% до 1% стрихнина.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1002; Нарушение авторских прав?; Мы поможем в написании вашей работы!