
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесие в гетерогенных системах
Принцип смещения равновесия
Состояние равновесия какой-либо системы при заданных внешних условиях (температура, давление и др.) характеризуется определёнными концентрациями компонента. При изменении внешних условий равновесие нарушается и в системе возникают процессы, идущие в сторону достижения нового состояния равновесия, которое отвечает новым условиям. Направление таких процессов устанавливается принципом смещения равновесия или принципом Ле Шателье, вытекающим из второго начала термодинамики:
внешние воздействия, нарушающие равновесие, вызывают в равновесной системе процессы, ослабляющие эффект внешнего воздействия.
Согласно этому принципу, протекание изотермических процессов с повышением температуры замедляется. Эндотермические процессы с повышением температуры ускоряются.
Реакции, которые сопровождаются увеличением объёма системы, замедляются при повышении внешнего давления и ускоряются при его уменьшении.
Повышение внешнего давления в реакции, идущей с увеличением объёма, приводит к тому, что равновесие устанавливается при меньшем количестве вновь образующих веществ, дающих это увеличение объёма. При уменьшении внешнего давления в этой системе реакция образования новых веществ пойдет дальше.
Увеличение концентрации любого из веществ, участвующих в реакции, вызывает смещение равновесия в сторону, уменьшающую концентрацию этого вещества.
ФАЗОВЫЕ РАВНОВЕСИЯ
В металлургических процессах обычно участвуют разнородные тела. В начальный период плавки наряду с расплавленной сталью и шлаком присутствуют и твердые шихтовые материалы. Жидкая сталь взаимодействует со шлаком. В структуре стали наряду с однородным металлом присутствуют различные включения, состоящие из оксидов, карбидов, сульфидов. При термической обработке стали происходят сложные физические и химические превращения, в которых участвуют и химические и соединения и растворенные в стали химические элементы.
Подобные смеси разнородных, взаимодействующих между собой тел, называют системами.
Равновесия в гетерогенных системах, в которых не происходит химическое взаимодействие между компонентами, а имеют место лишь фазовые переходы, то есть процессы перехода компонентов из одной фазы в другую, называются фазовыми равновесиями. Рассмотрим общее условие равновесия в гетерогенных системах.
Равновесие между чистой жидкостью и её паром (а так же равновесие между твердым веществом и его паром) имеет место тогда, когда давление пара равно давлению насыщенного пара при данной температуре, так как в этом случае скорости испарения и конденсации равны.
Если имеется не чистая жидкость, а раствор, причём, различные содержащиеся в нем вещества могут испаряться, то в условиях равновесия при данной температуре каждому летучему компоненту раствора отвечает определенное давление его паров. Это давление называется парциальным давлением насыщенного пара данного компонента. Парциальное давление насыщенного пара зависит уж е не только от температуры, но и от состава раствора. Парциальное давление насыщенного пара отвечает такой концентрации пара, при которой скорости испарения и конденсации данного компонента одинаковы.
Условием фазового равновесия между двумя конденсированными фазами является равенство парциального давления насыщенного пара каждого данного компонента над обеими фазами.
Если какой-нибудь компонент над одной из фаз обладает большим давлением насыщенного пара, чем над другой, то он будет переходить из первой фазы во вторую до тех пор, пока в результате изменения содержания компонента не установится равенство парциальных давлений насыщенного пара этого компонента над обеими фазами.
Закон равновесия фаз (правило фаз)
Закон равновесия фаз основывается на втором законе термодинамике и относится к системам, находящимся в равновесии:
сумма числа степеней свободы системы и числа её фаз равна сумме числа независимых компонентов и числа внешних факторов, влияющих на равновесие этой системы
С+Ф=К+n, (46)
где С - число термодинамических степеней свободы системы при равновесии; Ф – число фаз системы; К – число независимых компонентов – наименьшее число компонентов системы, достаточное для количественного выражения состава каждой фазы системы в отдельности; n - число внешних факторов (температура, давление).
Число компонентов К можно найти, если из числа всех присутствующих в системе веществ вычесть число возможных между ними химических реакций.
В металлургических процессах незначительные изменения давления не оказывают ощутимого влияния на свойства металлических сплавов. Для металлургических систем
С= К-Ф+ 1. (47)
Если система двухвариантна (при наличии одной фазы), то можно изменять в известных пределах температуру и концентрацию, что не вызовет изменения числа или вида фаз системы.
Если система одновариантна (две фазы – идет процесс плавления или кристаллизации двухкомпонентного сплава), то, не изменяя числа или вида фаз, можно изменять произвольно только температуру, или только концентрацию, причем с изменением одного из этих параметров другой параметр не сохраняет прежнего значения, а изменяется в соответствии с первым.
Правило фаз широко применяется при термодинамическом анализе различных систем. Например, по числу степеней свободы можно заранее узнать, какими факторами необходимо задаться для однозначного определения равновесных концентраций компонентов системы.
При условии сохранения равновесия между двумя фазами при фазовом переходе выполняется соотношение (уравнение Клаузиуса-Клапейрона):
 . (48)
. (48)
Для испарения и сублимации оно связывает изменение давления насыщенного пара с температурой (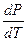 ), изменение объёма (Δ V) и тепловой эффект процесса (L – теплота испарения).
), изменение объёма (Δ V) и тепловой эффект процесса (L – теплота испарения).
Для процессов плавления и полиморфного превращения уравнение связывает изменение температуры перехода с давлением, соответствующее изменения объёма и тепловой эффект.
Так как при плавлении и полиморфном превращении Δ V всегда невелико, то в соответствии с принципом смещения равновесий температура слабо изменяется при изменении давления. В процессах испарения и сублимации Δ V всегда бывает большим и, следовательно, изменение давления сильнее влияет на температуру.
Пример. Соотношение между карбонатом кальция, оксидом кальция и углекислым газом при равновесии определяется реакцией
CaCO3 (тв) = CaO (тв) + СО2 (г).
Число компонентов К = 3-1 = 2. Состав каждой из трех фаз, присутствующих в смеси, можно охарактеризовать, указав количество в них всего лишь двух соединений, например CaO и СО2 . Если рассматриваемая система находится в равновесии, то любому значению температуры соответствует определенное давление углекислого газа (условие химического равновесия). Согласно правилу фаз С= 2-3+ 2=1. Следовательно, указанные три фазы могут сосуществовать в определенном интервале температур, то есть число степеней свободы равно единице.
ГЕТЕРОГЕННЫЕ МЕТАЛЛУРГИЧЕСКИЕ РЕАКЦИИ
|
|
Дата добавления: 2014-12-08; Просмотров: 646; Нарушение авторских прав?; Мы поможем в написании вашей работы!