
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічна кінетика та рівновага
Під швидкістю хімічних реакцій розуміють зміну концентрацій реагуючих речовин за одиницю часу
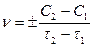 ,
,
де С1 і С2 – відповідно початкова та кінцева концентрації реагуючих речовин;
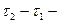 тривалість перебігу реакції.
тривалість перебігу реакції.
 На швидкість хімічної реакції впливає ряд факторів, серед яких можна виділити природу та концентрацію реагуючих речовин, площу поверхні їх контакту, температуру, наявність каталізатора.
На швидкість хімічної реакції впливає ряд факторів, серед яких можна виділити природу та концентрацію реагуючих речовин, площу поверхні їх контакту, температуру, наявність каталізатора.
Для перебігу хімічної реакції необхідне зіткнення між молекулами. Але не кожне зіткнення приводить до хімічної взаємодії. Молекули, що зіткнулися, повинні мати кількість енергії, достатню для послаблення та розриву зв’язків у молекулах. Надлишкова енергія, яку повинні мати молекули для того, щоб зіткнення зумовило утворення нової речовини, називається енергією активації, а молекули, що мають таку енергію, - активними. Енергія активації залежить від природи реагуючих речовин. Наприклад, водень з фтором реагують з вибухом навіть при кімнатній температурі, а взаємодія водню з бромом відбувається повільно навіть при нагріванні.
Легко змінюється швидкість хімічних реакцій, енергія активації яких становить 40-120 кДж / моль.
Для твердих речовин велике значення має площа поверхні контакту між реагуючими речовинами. Чим більше площа поверхні контакту, тим більша швидкість реакції. Такі реакції пов’язані з перенесенням речовин, при яких поверхня очищається від продуктів реакції. Наприклад, при згорянні шматка вугілля швидкість реакції буде залежати і від швидкості видалення оксиду вуглецю (ІV) з поверхні вугілля.
Залежність між концентрацією речовин, що реагують, і швидкістю хімічних реакцій математично відображається законом діючих мас, який був відкритий російським вченим М.М. Бекетовим (1865 р.) і норвезьким вченими К. Гульдбергом і П. Вааге (1867 р.):
аА + вВ = сС;
V 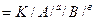 .
.
Швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин, взятих у степенях, що дорівнюють їх стехіометричним коефіцієнтам. Швидкість реакції характеризується константою швидкості К, величина Якої залежить від природи реагуючих речовин, температури та наявності каталізатора, але не залежить від концентрації речовин.
Ідеальні гази та розбавлені речовини підлягають закону діючих мас.
При підвищенні температури швидкість реакції різко збільшується. Згідно з правилом Вант-Гоффа, при підвищенні температури на 100С швидкість реакції зростає в 3-4 рази.
Математично це відображається формулою
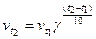 ,
,
де 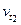 - кінцева швидкість реакції;
- кінцева швидкість реакції;
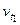 - початкова швидкість реакції;
- початкова швидкість реакції;
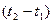 - різниця температур;
- різниця температур;
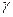 - температурний коефіцієнт Вант – Гоффа.
- температурний коефіцієнт Вант – Гоффа.
Це правило справедливе для інтервалу температур 0-2000С. Згідно з теорією Арреніуса, реакція відбувається тільки між частинками, запас енергії яких відповідає певному рівню. При поглинанні теплоти енергетичний рівень частинок реагуючих речовин підвищується, вони стають активними. При цьому збільшується швидкість їх руху, тобто при підвищенні температури реакція прискорюється.
Швидкість хімічної реакції змінюють також каталізатори – речовини, які впливають на перебіг хімічної реакції, беруть участь у ній, але самі, внаслідок реакції, кількісно та якісно не змінюються. Зміна швидкості реакції під впливом каталізаторів називається каталізом. Каталізатори бувають у різних агрегатних станах.
Каталіз позитивний, якщо швидкості реакції збільшуються і негативний, якщо вони зменшуються. Найбільше практичне використання має позитивний каталіз (наприклад, процеси добування аміаку, азотної та сірчаної кислоти, штучного моторного пального, синтетичного каучуку).
За агрегатним станом усіх компонентів реакції розрізняють гомогенний і гетерогенний каталіз. Гетерогенний каталіз – це процес, при якому речовини, що приймають участь у реакції, і каталізатор перебувають у різних агрегатних станах. Прикладом гетерогенного каталізу може бути реакція добування аміаку, окислення оксиду сірки (ІV) до оксиду сірки (VІ). Гомогенний каталіз – процес, при якому речовини, що реагують і каталізатор перебувають в однаковому агрегатному стані, наприклад, реакція стерифікації.
Каталізатори, що прискорюють хімічні реакції, називаються активаторами, а ті, що сповільнюють їх, - інгібіторами.
Дія каталізаторів виявляється через проміжні сполуки:
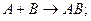
1) 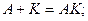 2)
2) 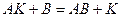 .
.
За напрямком перебігу реакції поділяють на необоротні та оборотні.
Необоротні реакції відбуваються до кінця, до повного витрачання однією з вихідних речовин. Внаслідок таких реакцій утворюється осад, газоподібні речовини, або малодисоційовані сполуки.
Наприклад:
а) ВаСl2 + H2SO4 = BaSO4↓ + 2HCl;
Осад
б) Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O;
Газ
К2SO3 + H2SO4 = K2SO4 + SO2↑ + H2O;
в) H2SO4 + 2 NaOH = Na2SO4 + 2 H2O.
|
|
Дата добавления: 2014-12-08; Просмотров: 581; Нарушение авторских прав?; Мы поможем в написании вашей работы!