
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Малодисоційовані сполуки
|
|
|
|

Реакції, які відбуваються як у прямому, так і в зворотному напрямках, називаються оборотними. Межею перебігу оборотних реакцій є стан динамічної рівноваги, яка характеризується рядом ознак.
1. У момент досягнення хімічної рівноваги швидкість прямої реакції дорівнює швидкості зворотної.
2. Концентрації вихідних речовин і кінцевих продуктів у процесі реакції не змінюються.
3. Хімічна рівновага рухома і може порушуватись під впливом зовнішніх факторів.
У міру зменшення концентрації вихідних речовин швидкість прямої реакції зменшується, а швидкість зворотної – збільшується.
Коли швидкості прямої і зворотної реакцій зрівнюються, встановлюється хімічна рівновага.
Оскільки процес не припиняється, але кількісні зміни не спостерігаються, то такий стан називають динамічною рівновагою. Кількісною характеристикою стану рівноваги для реакції
А + В = АВ є константа хімічної рівноваги kp.
Згідно із законом діючих мас, швидкості прямої v1 і зворотної v2 реакцій дорівнюють:
v1 = k1/A/ /B/; v2 = k2/AB/.
У момент досягнення динамічної рівноваги швидкість прямої реакції дорівнює швидкості зворотної: v1 = v2, звідки
k1/A/ /B/ = k2/AB/.
Відношення констант швидкості прямої та зворотної реакції називається константою рівноваги kp
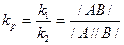 ,
,
де А В – рівноважна концентрація продуктів реакцій;
/A/, /В/ - рівноважні концентрації вихідних речовин.
Вираз константи рівноваги показує, що за умов рівноваги концентрації всіх реагуючих речовин взаємозв’язані. Константа рівноваги залежить від природи реагуючих речовин і від температури.
Система може перебувати у стні рівноваги, доки не зміниться одна з умов рівноваги.
Закономірності, які виявляються при порушенні рівноваги, підлягають принципу Ле Шательє: якщо на систему, що знаходиться в стані динамічної рівноваги, подіяти зовнішніми факторами (змінити тиск, концентрацію або температуру), то хімічна рівновага зміщується в напрямку процесу, який зменшить цю дію.
|
|
|
Із принципу Ле Шательє можна зробити декілька висновків.
1. При збільшенні концентрації будь якої з речовин, що беруть участь у реакції, рівновага зміщується у бік витрати цієї речовини, при зменшенні концентрації будь якої з речовин рівновага зміщується у бік утворення цієї речовини.
2. При збільшенні тиску (для газоподібних речовин) хімічна рівновага зміщується у бік зменшення об’єму і навпаки.
3. При підвищенні температури хімічна рівновага зміщується у бік ендотермічного процесу і навпаки.
Врахування принципу Ле Шательє дає змогу керувати хімічними процесами у виробництві. Підбираючи умови проведення хімічних реакцій, можна збільшити вихід потрібних речовин, знизити виробничі витрати, підвищити рентабельність виробництва.
Тема 4. Систематика хімічних елементів
Періодична система елементів Д.І. Менделєєва та її значення. Хімічні елементи в периодичній системі. Зміна властивостей хімічних елементів та їх сполук. Енергія іонізації, спорідненість до електрона, електронегативність.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 3652; Нарушение авторских прав?; Мы поможем в написании вашей работы!