
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водневий показник. Гідроліз солей
|
|
|
|
Наявність іонів водню відіграє суттєву роль у багатьох хімічних і біологічних процесах. Активність багатьох ферментів біологічних каталізаторів – залежить від вмісту іонів водню. Наприклад, пепсин шлункового соку діє в сильнокислому середовищі, каталаза крові – в нейтральному. Так, при порушеннях концентрації водневих іонів виникають різні захворювання, оскільки припиняється дія ферментів. Біохімічні процеси, які супроводжують виробництво багатьох продуктів харчування (хліб, чай, сир, тощо), відбуваються при певній реакції середовища. Тому визначення концентрації водневих іонів відіграє велику роль у багатьох галузях хімії, біології, ферментології, сільського господарства.
Прикладом речовини, у якій кількість іонів водню Н+ дорівнює кількості гідроксильних груп ОН-, є вода. Оскільки вода слабкий електроліт, вона частково дисоціює на іони:
НОН = Н+ +ОН-.
Завдяки здатності атома кисню за рахунок неподіленої пари електронів утворювати донорно-акцепторний зв’язок, іон водню у воді існує у вигляді іона гідроксонію Н3О+.
Константа дисоціації води, згідно із законом діючих мас, дорівнює:
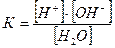 .
.
З цього рівняння знайдемо іонний добуток води:
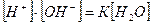 ,
,
де К = 1,8 10-16 при 250С.
Концентрація недисоційованих молекул води визначається за співвідношенням
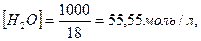
оскільки вода перебуває практично в недисоційованому стані.
 |
Підставивши відомі величини у формулу іонного добутку води, отримаємо:
 .
.
Оскільки концентрація іонів водню у воді дорівнює концентрації гідроксильних груп ОН-, то з іонного добутку води визначаємо концентрацію іонів водню у воді:
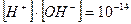 ;
;
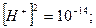

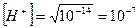 .
.
У кислому і лужному середовищі концентрації іонів водню і гідроксильних груп будуть змінюватись, але спряжено, оскільки іонний добуток величина стала. Отже, якщо концентрація іонів водню дорівнює 10-7, то й концентрація гідроксильних груп 10-7. У кислому середовищі концентрація іонів водню більша, а в лужному – відповідно менша. Наприклад, концентрація іонів водню дорівнює 10-2. Тоді концентрація гідроксильних груп повинна бути 10-12.
|
|
|
Концентрація іонів водню виражається дуже малими величинами, тому на практиці зручніше користуватися водневим показником рН, який зв’язаний з концентрацією іонів водню такою залежністю:
 .
.
Підставивши в це рівняння значення концентрації іонів водню у воді, дістанемо для неї рН = 7:

тобто, в нейтральному середовищі рН = 7. Значення концентрації іонів водню більше 10-7 відповідає кислому середовищу, менше 10-7 –лужному. Так, при концентрації іонів водню 10-3 рН середовища дорівнює 3, тобто середовище кисле. Якщо концентрація іонів водню дорівнюватиме 10-10, то рН = 10, тобто середовище лужне.
Отже, значення рН від 1 до 7 відповідає кислому середовищу, рН = 7 – нейтральному і від 7 до 14 – лужному.
Існують спеціальні методи визначення рН: колориметричний та електрометричний.
Колориметричний метод грунтується на зміні забарвлення індикаторів залежно від концентрації в розчині іонів водню і гідроксид-іонів. Забарвлення індикаторів змінюється під впливом іонів водню або гідроксид-іонів, при цьому змінюється співвідношення між дисоційованою і молекулярною формами індикатора, що впливає на його забарвлення.
Найпоширенішими індикаторами є лакмус, фенолфталеїн, метилоранж. Їх використовують для якісного визначення реакції середовища. Для напівкількісного аналізу використовують універсальний індикатор. Це суміш індикаторів, яка випускається у вигляді розчину або фільтрувального паперу, просоченого цією сумішшю. Такий папір змочують розчином, що досліджується, і порівнюють його забарвлення з еталонною шкалою. Кожному кольору шкали відповідає певне значення рН, яке виражається цілим числом.
|
|
|
Для точного визначення рН розчинів використовують спеціальні прилади – рН – метри.
Солі при розчиненні у воді здатні змінювати рН розчину. Це пов’язано з тим, що при розчиненні іони солі вступають у взаємодію з полярними молекулами води, відбувається гідратація іонів. Іони сильних основ і кислот утворюють з водою сильні гідрати і при цьому не спостерігається дисоціація води. Іони слабких основ і кислот здатні розщеплювати молекули води, при цьому катіони взаємодіють з гідроксид-іонами, а аніони – з катіонами водню.
Процес взаємодії солі з водою, при якому змінюється рН середовища називається гідролізом.
Гідроліз може відбуватися ступінчасто. Внаслідок послідовного зменшення зарядів іонів гідроліз найлегше відбувається за першим ступенем.
Якщо сіль утворена сильною основою і слабкою кислотою, то при гідролізі утворюється кисла сіль і основа. Реакція середовища лужна:
КСN + H2O 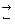 HCN + KOH;
HCN + KOH;
CN- + H2O 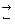 HCN + OH -.
HCN + OH -.
Якщо сіль утворена сильною кислотою і слабкою основою, то при гідролізі утворюється основна сіль і кислота. Реакція середовища кисла:
NН4Сl + H2O 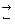 NH4OH + HCl,
NH4OH + HCl,
NH4+ + H2O 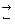 NH4OH + H+.
NH4OH + H+.
Якщо сіль утворена слабкою кислотою і слабкою основою, то при гідроліз відбувається до кінця, утворюється слабка кислота і слабка основа. Реакція середовища слабкокисла або слабколужна (залежно від сили кислоти й основи).
Гідроліз відбувається за катіоном і аніоном:
СН3СООNH4 + H2O 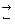 CH3COOH + NH4OH;
CH3COOH + NH4OH;
CH3COO- + NH4+ + H2O 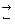 CH3COOH + NH4OH.
CH3COOH + NH4OH.
Якщо сіль утворена сильною кислотою і сильною основою, то гідроліз не відбувається. Реакція середовища нейтральна. Прикладом таких солей є: NaCl, Na2SO4, KNO3, KCl тощо.

Тема 6. Електрохімічні процеси.
Окисно-відновні процеси, їхня класифікація. Складання рівнянь окисно-відновних реакцій. Поняття про електродні потенціали. Стандартний водневий електрод і воднева шкала потенціалів. Рівняння Нернста. Гальванічні елементи, ЕРС та її вимірювання. Електродні процеси. Електрохімічна та концентраційна поляризація. Акумулятори. Електроліз. Послідовність електродних процесів. Електроліз при нерозчинному та розчинному анодах. Закони Фарадея. Вихід за струмом. Практичне застосування електролізу. Основні види корозії. Хімічна корозія. Електрохімічна корозія. Корозія під дією блукаючого струму. Методи захисту від корозії: легування, електрохімічний захист, захисні покриття, зміна властивостей корозійного середовища. Інгібітори корозії.
|
|
|
Окислювально-відновними називаються реакції, які супроводжуються зміною ступеня окислення елементів.
Під ступенем окислення розуміють умовний заряд, який виникає внаслідок зміщення електронних пар у бік більш електронегативного елементу. У сполуках, які складаються з атомів одного елементу, ступені окислення дорівнюють нулю. Ступінь окислення елементів у сполуках, що складаються з різних атомів, визначають за правилом: сума ступенів окислення всіх атомів, що є в сполуці, повинна дорівнювати нулю.
 При цьому потрібно враховувати, що ступінь окислення водню дорівнює + 1, а кисню - -2:
При цьому потрібно враховувати, що ступінь окислення водню дорівнює + 1, а кисню - -2:  ;
; 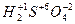 ;
; 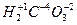 .
.
Ступінь окислення атомів вуглецю в органічних сполуках визначається за таким самим принципом, тільки за основу береться положення, що сума ступенів окислення кожного атома вуглецю та сполучених з ним груп повинна дорівнювати нулю:
О 
 |
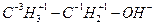 ;
;  ;
; 
 |
ОН 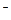
При зміні ступеня окислення одночасно відбуваються два процеси: окислення і відновлення. Окисленням називається процес віддачі електронів. Атоми, молекули або іони, що віддають електрони, називаються відновниками,а самі при цьому окислюються. Відновленням називається процес приєднання електронів. Атоми, молекули або іони, які приєднують електрони, називаються окислювачами, а самі при цьому відновлюються.
 Окислювально-відновні реакції можна поділити на три види: реакції міжмолекулярного окислення-відновлення; реакції внутрішньомолекулярного окислення-відновлення; реакції самоокислення-самовідновлення.
Окислювально-відновні реакції можна поділити на три види: реакції міжмолекулярного окислення-відновлення; реакції внутрішньомолекулярного окислення-відновлення; реакції самоокислення-самовідновлення.
При складанні рівнянь окислювально-відновних реакцій необхідно визначити окислювач, відновник, записати схему електронного або електронно-іонного балансу (якщо реакція йде у водному розчині) і порівняти коефіцієнти. Засновниками електронно-іонної теорії окислювально-відновних реакцій є М.В. Писаревський, Я.І. Михайленко, М.О. Шилов, О.М.Берхенгейм.
|
|
|
1. Реакції міжмолекулярного окислення-відновлення.
При цих реакціях окислювач і відновник є різними речовинами й обмін електронами відбувається між елементами або іонами, що містяться в різних сполуках. Таких реакцій переважна більшість.
Якщо реакції відбуваються між елементами не в розчинах, то для них окислювально-відновний процес зображується у вигляді рівнянь електронного балансу.

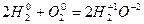
Відновник Но2 - 2 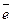 = 2Н+ 2(окислення);
= 2Н+ 2(окислення);
 |
Окислювач Оо2 + 4
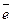 = 2О
= 2О  1 (відновлення).
1 (відновлення).
При цьому зліва записуються окислювач і відновник, справа – продукти реакції. За зміною ступенів окислення елементу визначають кількість електронів, що брали участь у даному процесі.
При цьому слід врахувати, що кількість електронів, що віддаються, повинна дорівнювати кількості електронів, що приєднуються. Їх кількості зрівнюються домноженням першого і другого рівнянь на число, яке є спільним множником для обох рівнянь. Одержані числа записують в рівняння реакцій як коефіцієнти.
Якщо реакції відбуваються в розчинах, то обмін електронів між іонами відбувається за участю води. Окислювально-відновні процеси в такому разі зображують у вигляді рівнянь електронно-іонного балансу, враховуючи дію іонів Н+, ОН- і молекул води:
 ;
;
 |
Відновник 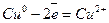 1 (окислення)
1 (окислення)
Окислювач 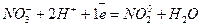 2 (відновлення)
2 (відновлення)
 |
 .
.
Останнє рівняння показує, що в окислювально-відновному процесі беруть участь: один атом міді, два іони 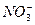 і чотири іони
і чотири іони 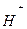 . При цьому утворюється: один іон
. При цьому утворюється: один іон  , дві молекули
, дві молекули 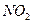 і дві молекули
і дві молекули
 . Кількість електронів, що беруть участь в даному процесі, дорівнює двом. Реакція відбувається в кислому середовищі (за участю іонів водню):
. Кількість електронів, що беруть участь в даному процесі, дорівнює двом. Реакція відбувається в кислому середовищі (за участю іонів водню):
 О
О 
 + К2SO4 +
+ К2SO4 +
Н+1
 +
+ 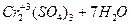 .
.
 Відновник
Відновник 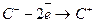 3 (окислення);
3 (окислення);
 |
Окислювач
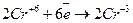 1 (відновлення).
1 (відновлення).
Для органічних сполук записується в основному електронний баланс, оскільки це сполуки з ковалентним типом зв’язку.
2. Реакції внутрішньомолекулярного окислення-відновлення.
Це реакції, в яких окислювач і відновник містяться в одній сполуці. При таких реакціях обмін електронами відбувається в середині самої молекули:
 ;
;
 Окислювач
Окислювач  1 (відновлення)
1 (відновлення)

Відновник 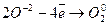 1 (окислення).
1 (окислення).

3. Реакції самоокислення-самовідновлення.
 Цей тип самоокислення-самовідновлення називають ще й реакціями диспропорціонування. У них і окислювачем, і відновником є атоми одного й того ж самого елемента, ступінь окислення якого проміжний:
Цей тип самоокислення-самовідновлення називають ще й реакціями диспропорціонування. У них і окислювачем, і відновником є атоми одного й того ж самого елемента, ступінь окислення якого проміжний:
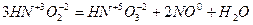 ;
;

 Окислювач
Окислювач 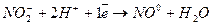 2 (відновлення)
2 (відновлення)
Відновник 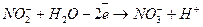 1 (окислення)
1 (окислення)
____________________________________________________
 ;
;
 .
.
Оскільки реакція йде в кислому середовищі при наявності води, то іони водню і молекули води приймають участь у процесі. Іон 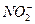 виступає і окислювачем, і відновником:
виступає і окислювачем, і відновником:

 Відновник
Відновник 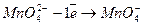 2 (окислення)
2 (окислення)
Окислювач  1(відновлення)
1(відновлення)
__________________________________________________________________________________  ;
;
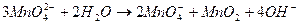 .
.
Іон 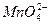 виступає і окислювачем, і відновником.
виступає і окислювачем, і відновником.
На перебіг окислювально-відновного процесу суттєво впливає реакція середовища. Кислоти і луги використовуються в таких випадках для добування солей і води.
Розглянемо, наприклад, дію перманганату калію та сульфіту натрію в кислому, лужному й нейтральному середовищах.
1. Кисле середовище
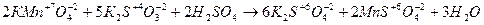 .
.
 Окислювач
Окислювач  2(відновлення)
2(відновлення)
Відновник 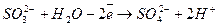 5 (окиснення)
5 (окиснення)
_________________________________________________________
 ;
;
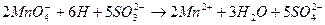 .
.
2. Нейтральне середовище
 .
.
 Окислювач
Окислювач 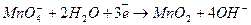 2 (відновлення)
2 (відновлення)
Відновник 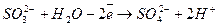 3 (окислення)
3 (окислення)
________________________________________________________
 ;
; 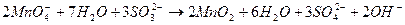 ;
; 

 .
.
3. Лужне середовище
 .
.
 Окислювач
Окислювач 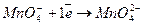 2 (відновлення)
2 (відновлення)
Відновник 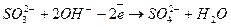 1 (окислення)
1 (окислення)
________________________________________________________
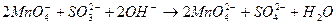 .
.
Отже, напрямок процесу окислення-відновлення залежить від того, які іони переважають у середовищі.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1255; Нарушение авторских прав?; Мы поможем в написании вашей работы!