
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Будова атома
|
|
|
|
Приклад 1. Що таке квантові числа? Яких значень вони можуть набувати?
Розв’язання. Рух електрона в атомі носить імовірний характер. Навколоядерний простір, у якому з найбільшою ймовірністю (0,9—0,95) може знаходитись електрон, називається атомною орбіталлю (АО). Атомна орбіталь, як будь-яка геометрична фігура, характеризується трьома параметрами (координатами), що одержали назву квантових чисел (n, l, m l). Квантові числа набувають не будь-яких, а визначених, дискретних значень. Сусідні значення квантових чисел розрізняються на одиницю. Квантові числа визначають розмір (n), форму (l) та орієнтацію (m l) атомної орбіталі у просторі. Займаючи атомну орбіталь, електрон утворює електронну оболонку, яка у електронів одного і того ж атома може мати різну форму (рисунок 1). Форми електронних оболонок аналогічні атомним орбіталям. Електронна оболонка характеризується чотирма квантовими числами (n, l, m l, ms).


Рисунок 1 – Форми s-, р- і d-електронних хмар (орбіталей)
Ці квантові числа пов’язані з фізичними властивостями електрона і, число n (головне квантове число) характеризує енергетичний (квантовий) рівень електрона; число l (орбітальне) – момент кількості руху (енергетичний підрівень), число m l ( магнітне) – магнітний момент, ms - спін. Спін електрона виникає при його обертанні навколо власної осі. Електрони в атомі повинні відрізнятися хоч би одним квантовим числом (принцип Паулі), тому що в АО може знаходитись не більше двох електронів, які відрізняються спінами (ms=±1/2). В таблиці 3 дані значення та визначення квантових чисел, а також кількість електронів на відповідному енергетичному рівні та підрівні.
Таблиця 3 – Значення квантових чисел і максимальне число електронів на квантових рівнях і підрівнях
|
|
|
| Квантовий | Магнітне квантове число m l | Число квантових орбіталей | Максимальна кількість електронів | |||||
| Рівень | Підрівень | У підрівні (2 l +1) | У рівні n2 | У підрівні 2(2 l +1) | У рівні 2n2 | |||
| Поз-начення | Головне кван-тове число n | Поз-начення | Орбітальне квантове число l | |||||
| K | S | |||||||
  L L
| S P | -1,0+1 | ||||||
  M M
| S P D | -1,0,+1 -2,-1,0,+1,+2 | ||||||
  N N
| S P D F | -1,0,+1 -2,-1,0,+1,+2 -3, -2, -1, 0, +1, +2, +3 |
Приклад 2. Складіть електронні формули атомів елементів із порядковими номерами 16 і 22. Покажіть розподіл електронів по орбіталях.
Розв’язання. Електронні формули відображають розподіл електронів в атомі за енергетичними рівнями, підрівнями (атомними орбіталями). Електронна конфігурація позначається групами символів n lx, де n — головне квантове число, l – орбітальне квантове число (замість нього указують відповідне позначення — s, p, d, f), х - кількість електронів у даному підрівні (орбіталі).
При цьому варто враховувати, що електрон займає той енергетичний підрівень, на якому він має найменшу енергію – менша сума n+ l (правило Клечковського). Послідовність заповнення енергетичних рівнів і підрівнів така:
1s®2s®2p®3s®3p®4s®3d®4p®5s®4d®5p®6s®(5d1)®4f®5d®6p® ®7s® (6d1-2) ®5f®6d®7p.
Через те що число електронів в атомі того чи іншого елемента дорівнює його порядковому номеру в таблиці Д. І. Менделєєва, то для елементів № 16 (сірка) і № 22 (титан) електронні формули мають вигляд
16S 1s22s22p63s23p4
22 Тi 1s22s22p63s23p63d24s2.
 Електронна структура атома може бути зображена також у вигляді схем розміщення електронів у квантових (енергетичних) ячейках, які є схематичним зображенням атомних орбіталей (АО). Квантову ячейку позначають у вигляді прямокутника, а електрони в цих ячейках позначають стрілками. У кожній квантовій ячейці може бути не більш двох електронів із протилежними спінами
Електронна структура атома може бути зображена також у вигляді схем розміщення електронів у квантових (енергетичних) ячейках, які є схематичним зображенням атомних орбіталей (АО). Квантову ячейку позначають у вигляді прямокутника, а електрони в цих ячейках позначають стрілками. У кожній квантовій ячейці може бути не більш двох електронів із протилежними спінами 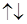 .
.
|
|
|
Орбіталі даного підрівня заповнюються спочатку по одному електрону з однаковими спінами, а потім по другому електрону з протилежними спінами (правило Хунда):
| ↑↓ | ||||||||
| ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||||
| ↑↓ | ↑↓ | ↑ | ↑ |
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 829; Нарушение авторских прав?; Мы поможем в написании вашей работы!