
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретические основы аналитической химии
|
|
|
|
ВОПРОСЫ КОНТРОЛЬНЫХ ЗАДАНИЙ
ОТДЕЛЬНЫХ ТЕМ ДИСЦИПЛИНЫ И
МЕТОДИЧЕСКИЕ СОВЕТЫ ПО ИЗУЧЕНИЮ
Выполнение контрольной работы
В соответствии с учебным планом по дисциплине «Аналитическая химия и физико-химические методы анализа», студентам следует выполнить одну контрольную работу. К написанию контрольной работы надо приступить после полного изучения курса по учебнику в соответствии с программой и методическими указаниями.
Задания для контрольных работ расположены сразу после теоретического обоснования и имеют сквозную нумерацию. Вариант задания определяется по последним двум цифрам шифра в таблице 1. Шифр определяется по последним цифрам зачетной книжки.
При оформлении работы вопросы контрольного задания необходимо переписать полностью в тетрадь и указать номер вопроса в соответствии с шифром.
После каждого вопроса приводится его решение и теоретическое обоснование. Ответы должны быть четкими и по существу. Уравнения реакций должны быть приведены в молекулярном, полном и сокращенном ионном виде. Для окислительно-восстановительных реакций нужно приводить уравнения электронного баланса. При решении задач необходимо приводить ход расчетов и все приведенные формулы пояснять, указывая размерность величин.
Работы должны быть аккуратно оформлены. Для замечаний рецензента оставляются поля. В конце работы следует указать список использованной литературы, поставить подпись и дату выполнения работы.
При получении проверенной контрольной работы следует внимательно ознакомиться с замечаниями рецензента и сделать соответствующие исправления и дополнения к работе. Исправленная работа представляется к собеседованию с преподавателем.
|
|
|
Если контрольная работа возвращается с надписью «На доработку», то ее необходимо доработать в соответствии с замечаниями рецензента и вернуть на повторную проверку. Только после получения работы с рецензией преподавателя «К собеседованию», студент допускается к ее защите. Студенты, получившие зачет по контрольной работе, посетившие все лекции и лабораторные занятия, допускаются к экзамену.
Таблица 1
ВАРИАНТЫ КОНТРОЛЬНЫХ ЗАДАНИЙ
Все студенты дополнительно выполняют задание № 161
| Последние две цифры шифра | Номера задач для контрольных работ |
| 1 11 21 29 41 62 72 82 94 102 121 141 | |
| 2 10 22 36 42 61 76 83 93 101 122 142 | |
| 3 9 23 31 43 63 80 81 89 103 123 143 | |
| 4 12 24 34 44 64 71 84 100 104 124 144 | |
| 5 13 25 40 45 65 70 85 92 105 125 145 | |
| 6 14 26 39 46 66 75 86 100 106 126 146 | |
| 7 15 27 40 47 67 80 87 93 107 127 147 | |
| 8 16 28 31 48 68 74 88 100 108 128 148 | |
| 9 17 29 39 49 58 75 89 101 109 129 149 | |
| 10 18 30 34 50 69 77 81 90 110 130 145 | |
| 4 19 24 36 51 70 80 85 94 111 131 150 | |
| 5 20 25 31 52 63 77 89 97 112 132 151 | |
| 1 15 23 39 44 61 78 92 100 113 133 152 | |
| 2 12 25 42 47 63 80 84 92 104 125 150 | |
| 5 13 23 36 41 62 72 85 94 124 131 152 | |
| 7 15 26 39 48 66 70 82 93 104 123 149 | |
| 9 18 30 36 51 67 75 87 90 108 127 145 | |
| 2 15 23 34 42 66 74 84 96 105 125 143 | |
| 9 17 25 43 58 68 77 83 89 114 129 150 | |
| 10 16 29 42 55 66 74 85 98 108 128 148 | |
| 1 15 32 51 56 63 70 88 99 104 132 141 | |
| 2 14 25 39 42 64 78 85 101 114 123 142 | |
| 3 11 22 38 43 55 63 83 96 117 136 151 | |
| 4 17 23 29 51 60 72 81 92 115 129 158 | |
| 8 10 25 34 45 64 70 86 100 105 126 144 | |
| 9 16 30 36 52 69 80 89 97 109 132 148 | |
| 10 19 25 39 48 58 77 85 94 113 128 149 | |
| 4 20 34 44 55 63 70 89 97 109 127 147 | |
| 5 14 25 39 47 68 80 87 94 112 132 151 | |
| 6 12 24 31 50 70 78 89 98 104 131 152 | |
| 7 17 27 36 48 52 61 80 92 110 133 158 | |
| 8 18 30 39 51 63 77 84 93 108 127 145 | |
| 9 14 23 42 55 64 74 87 95 102 128 143 | |
| 11 25 33 43 53 66 79 89 99 103 134 154 | |
| 12 24 32 46 58 68 80 96 101 114 133 155 | |
| 13 22 35 43 51 66 77 90 107 117 123 157 | |
| 3 15 28 40 49 61 75 85 100 109 127 147 | |
| 4 18 24 31 47 63 78 87 99 110 133 152 | |
| 10 14 26 36 14 58 69 80 94 111 129 149 | |
| 8 17 30 39 52 69 80 92 104 113 128 148 | |
| 1 16 21 36 43 64 70 86 93 108 129 149 | |
| 2 14 25 34 45 66 71 85 92 104 123 144 | |
| 3 12 26 40 46 68 75 88 101 110 131 151 | |
| 4 11 27 31 49 58 78 89 90 109 129 152 | |
| 5 12 25 39 47 68 74 87 92 105 125 144 | |
| 6 15 28 40 48 69 75 84 94 104 130 149 | |
| 7 16 29 34 51 66 77 85 96 108 132 154 | |
| 8 17 25 29 45 60 72 86 92 116 126 151 | |
| 9 13 26 39 49 66 74 85 97 113 131 153 | |
| 10 23 33 42 55 70 80 87 100 114 120 152 | |
| 4 12 24 31 48 52 77 84 107 117 123 156 | |
| 2 15 25 34 44 58 78 92 97 113 130 149 | |
| 3 14 27 40 51 61 76 84 93 106 126 146 | |
| 4 12 26 39 58 67 74 88 100 108 128 148 | |
| 5 14 27 36 48 64 70 86 94 107 125 150 | |
| 9 17 30 31 49 69 77 81 92 111 132 151 | |
| 10 19 28 35 42 63 75 89 96 102 127 145 | |
| 2 15 25 43 52 68 72 85 99 104 136 158 | |
| 3 11 23 39 43 64 73 87 95 115 130 154 | |
| 4 10 29 34 51 60 78 89 92 105 126 151 | |
| 5 13 28 36 42 58 74 88 91 108 127 146 | |
| 6 14 27 31 49 59 68 86 102 111 125 144 | |
| 7 19 25 38 48 52 77 84 90 114 128 158 | |
| 8 16 24 39 44 58 78 87 96 101 123 154 | |
| 9 18 23 34 42 55 74 88 99 117 129 149 | |
| 10 14 32 36 43 60 70 85 97 113 124 160 | |
| 1 9 34 45 58 69 80 89 100 104 126 159 | |
| 2 12 38 44 66 74 84 92 101 128 132 143 | |
| 4 19 25 39 50 63 82 87 96 114 136 144 | |
| 5 13 26 36 42 66 77 85 99 117 135 155 | |
| 6 15 28 35 40 64 78 81 102 127 139 151 | |
| 9 16 32 34 44 61 75 89 92 118 127 143 | |
| 8 14 23 39 41 67 73 88 91 115 132 146 | |
| 10 19 27 31 48 74 83 92 100 126 139 157 | |
| 2 13 25 36 42 69 70 89 103 128 138 154 | |
| 3 9 24 37 47 58 74 85 97 113 128 152 | |
| 4 10 28 34 44 55 62 82 99 117 127 147 | |
| 5 12 27 38 45 61 68 80 94 102 134 149 |
|
|
|
Аналитическая химия — это наука о методах качественного и количественного изучения состава вещества. В настоящее время химический анализ является одним из основных способов контроля продуктов питания, состава воздуха, воды, почв, удобрений, лекарственных препаратов. В последнее время появилось много частных предприятий по производству полуфабрикатов и готовой продукции, но ни одно производство не может выпускать качественную продукцию, отвечающую всем требованиям государственных стандартов, без лабораторного контроля на всех этапах.
Анализ может быть качественным и количественным. Качественный анализ предназначен для определения элементов, ионов, соединений, входящих в состав анализируемого вещества. Задача количественного анализа - определить количество элементов в соединениях и химических соединений в смесях. Качественный анализ предшествует количественному.
Теоретической основой аналитической химии являются знания, полученные при изучении общей, неорганической химии. Большое значение при изучении аналитической химии имеют знания основных законов химии, понятий о концентрации растворов, закона действия масс и химического равновесия, теории электролитической диссоциации, ионных реакций, гидролиза солей. Поэтому необходимо вспомнить из курса неорганической химии данные темы.
|
|
|
Аналитическая химия тесно связана с другими науками: физикой, математикой, биологией. Эти связи являются сложными, поэтому иногда очень трудно провести грань между фундаментальными науками. Это еще более усиливает значение аналитической химии в современном научном обществе, а следовательно, и для подготовки грамотных специалистов, владеющих методами аналитической химии.
Химические методы анализа сегодня не удовлетворяют современным требованиям. Для управления технологическими и биологическими процессами нужны быстрые методы анализа. Физико-химические методы анализа отличаются высокой чувствительностью и быстротой выполнения.
Инструментальные методы анализа занимают ведущее место в системе агрохимической службы страны, важную роль они приобретают при контроле загрязненности окружающей среды. Современная аналитическая химия широко использует достижения физики, квантовой механики; возникают новые современные «гибридные» методы.
Среди основных физико-химических методов широкое применение находят электрохимические, оптические и хроматографические.
Электрохимические методы анализа основаны на использовании процессов, протекающих на поверхности электрода или в приэлектродном пространстве. Любой электрический параметр (потенциал, сила тока, сопротивление и др.), функционально связанный с концентрацией анализируемого раствора и поддающийся измерению, может служить аналитическим сигналом.
Оптические методы анализа основаны на измерении оптических показателей анализируемых веществ, на изучении взаимодействия электромагнитного излучения с атомами или молекулами вещества, сопровождающегося излучением, поглощением или отражением лучистой энергии.
Хроматография - современный метод, позволяющий быстро и надежно определить содержание отдельных компонентов в смесях, концентрировать и идентифицировать компоненты. В биологии и агропромышленной сфере метод находит широкое применение для обнаружения пестицидов, контроля чистоты пищевых продуктов, очистки веществ.
|
|
|
Раздел 1. МЕТРОЛОГИЧЕСКИЕ ОСНОВЫ АНАЛИТИЧЕСКОЙ
ХИМИИ
Химический анализ - многостадийный процесс. Можно выделить следующие этапы анализа любого объекта: постановка задачи, выбор метода и схемы анализа, отбор пробы, подготовка пробы к анализу, проведение измерения, обработка результатов измерений. Это деление условно: каждый этап может быть относительно сложным и состоять из многих отдельных стадий. В данном разделе рассмотрим выбор метода химического анализа и обработку результатов измерений, а также некоторые общие положения этапа «измерения».
Основная задача химического анализа – определение количества вещества, поэтому прежде чем перейти к рассмотрению этапов анализа, условимся о единицах количества вещества и способах выражения концентрации, которые будут использованы в этой книге.
Единицы количества вещества
Моль. За единицу количества вещества принят один моль. Это такое количество вещества, которое содержит столько условных частиц, сколько атомов содержится в 0,012 кг углерода – 12, т.е. 6,02045 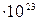 .
.
Для обозначения количества молей вещества используют символ n.
Молярная масса (М) –  это масса 1 моль вещества. Если имеется вещество массой m, то М= m/n. Молярная масса имеет размерность г/моль.
это масса 1 моль вещества. Если имеется вещество массой m, то М= m/n. Молярная масса имеет размерность г/моль.
Молярный объем (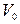 ) – это объем 1 моль вещества при нормальных условиях. Обычно эту величину используют для газов, в этом случае
) – это объем 1 моль вещества при нормальных условиях. Обычно эту величину используют для газов, в этом случае 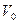 =22, 4
=22, 4 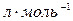 .
.
Молярный заряд (Q) – это общий заряд 1 моль вещества. Для однозарядных частиц Q=96485 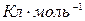 (число Фарадея, F), для z-зарядных Q=zF.
(число Фарадея, F), для z-зарядных Q=zF.
Способы выражения концентрации
Молярная концентрация С – отношение числа молей растворенного вещества к объему раствора.
Молярная концентрация эквивалента Сэк. - отношение числа моль-экв растворенного вещества к объему раствора.
Титр – количество граммов вещества, содержащееся в 1 мл раствора.
Массовая концентрация – отношение массы растворенного вещества 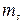 к объему раствора V, единицы массовой концентрации
к объему раствора V, единицы массовой концентрации  или
или 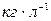 , а также кратные дольные единицы.
, а также кратные дольные единицы.
Объемная концентрация – отношение объема растворенного вещества к объему раствора.
Часто состав раствора или других объектов выражают в доле компонента от общего количества вещества.
«Доля» означает отношение числа частей компонента к общему числу частей объекта. В зависимости от выбранной единицы различают молярную (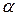 ), массовую (
), массовую (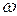 ), объемные (
), объемные (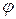 ) доли:
) доли:
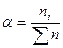 ,
, 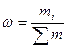 ,
, 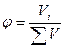 .
.
Долю выражают в процентах (массовую долю, выраженную в процентах, называют процентной концентрацией).
Моляльность – количество вещества в единице массы(1кг) растворителя.
Выбор метода анализа
Метод – это совокупность принципов, положенных в основу анализа безотносительно к конкретному объекту и определяемому веществу.
Методика – подробное описание всех условий и операций проведения анализа определенного объекта.
Чувствительность - метода или методики определяется тем минимальным количеством вещества, которое можно обнаруживать или определять данным методом.
Избирательность метода
Необходимо учитывать физические свойства анализируемого объекта: его агрегатное состояние, летучесть, гигроскопичность, механическую прочность и т.д. Определяющими при выборе метода анализа являются химические свойства образца. При этом важно знать и принимать во внимание: химические свойства основы образца, часто называемой матрицей анализируемого объекта; качественный химический состав образца; химические свойства определяемого компонента и сопутствующих примесей.
Точность анализа – это собирательная характеристика метода или методики, включающая их правильность и воспроизводимость.
Экспрессность метода
Требование к экспрессивности, т.е. быстроте проведения анализа, часто выдвигается как одно из основных при выборе метода или методики анализа.
Стоимость анализа
При выборе метода анализа нередко большую роль, особенно при проведении серийных и массовых анализов, играет стоимость химического анализа, куда входит стоимость используемой аппаратуры, реактивов, рабочего времени аналитика и иногда самой анализируемой пробы.
Автоматизация анализа
При проведении массовых однородных анализов следует выбирать метод, допускающий автоматизацию анализа, которая позволяет облегчить труд аналитика, заменив многие ручные, трудоемкие операции автоматическими, снизить погрешности отдельных операций, увеличить скорость проведения анализа, снизить его стоимость, проводить анализ на расстоянии и т.д.
Аналитический сигнал. Измерение
После отбора и подготовки пробы наступает стадия химического анализа, на которой и проводят обнаружение компонента или определение его количества. С этой целью измеряют аналитический сигнал. В отдельных случаях возможно непосредственное определение содержания.
В случае необходимости обнаружения какого-либо компонента обычно фиксируют появление аналитического сигнала – появление осадка, окраски, линии в спектре и т.д. Появление аналитического сигнала должно быть надежно зафиксировано. При определении количества компонента измеряют величину аналитического сигнала: массу осадка, силу тока, интенсивность линии спектра и т.д.
При измерении аналитического сигнала учитывают наличие полезного аналитического сигнала, являющегося функцией содержания определяемого компонента, и аналитического сигнала фона, обусловленного примесями определяемого компонента и мешающими компонентами в растворах, растворителях и матрице образца, а также «шумами», возникающими в измерительных приборах, усилителях и другой аппаратуре.
На основании существующей зависимости между аналитическим сигналом и содержанием находят концентрацию определяемого компонента. Обычно при этом используют методы градуировочного графика, стандартов или добавок. Описанные в литературе другие способы определения содержания компонента, как правило, являются модификацией этих трех основных методов.
Во всех методах определения неизвестного содержания компонента используют функциональную зависимость y=Sx. Коэффициент чувствительности S (иногда его называют просто чувствительность) характеризует отклик аналитического сигнала на содержание компонента. Коэффициент чувствительности – это значение первой производной градуировочной функции при данном определенном содержании.
При проведении химического анализа обычно не ограничиваются единичным определением, а проводят несколько параллельных определений (как правило, 3-5) для одной и той же пробы в одинаковых условиях. Средний результат параллельных определений называют результатом анализа и обозначают через 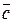 или
или 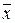 . Отклонение результата анализа от истинного содержания определяемого компонента (
. Отклонение результата анализа от истинного содержания определяемого компонента (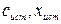 ) называют погрешностью (или ошибкой) определения.
) называют погрешностью (или ошибкой) определения.
Погрешности химического анализа
Погрешностью измерения называют отклонение результата измерения от истинного значения измеряемой величины.
Отношение абсолютной погрешности измерения к истинному значению измеряемой величины называется относительной погрешностью измерения.
Погрешность измерения, которая при повторных измерениях остается постоянной или закономерно изменяется, называется систематической погрешностью.
Погрешность, которая при повторных измерениях изменяется случайным образом, называется случайной погрешностью измерения.
Грубые погрешности, существенно превышающие ожидаемые при данных условиях, называются промахами.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1142; Нарушение авторских прав?; Мы поможем в написании вашей работы!