
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм действия ионообменных смол
|
|
|
|
Сырье
| Метод | Сырье для основы полимера | Мостико-образователи | Ионогенные группы | |
| Катиониты | Аниониты | |||
| Поликонден-сация | Многоатомные фенолы, алифатические и ароматические амины, мочевина и ее производные | Формальдегид, галогенпроизводные углеводородов, эпоксисоединения | –SO3 H, –PO3 H2, −COOH, гидроксильные группы и др. | Первичные, вторичные, третичные амины; группы аммониевых оснований |
| Полимеризация | Вещества, содержащие винильные группы (стирол, акриловые соединения и др.) | Ди- и поливиниловые соединения (дивинил- и тривинилбензол) |
Первоначально полимерные иониты получали только по первому способу, например из фенолсульфокислоты, образующей в смеси с фенолом сетчатый полимер при поликонденсации с формальдегидом. По такой схеме, например, получают бифункциональный катионит КУ-1.

Иониты, получаемые поликонденсацией, как правило, полифункциональны, сетчатость их структуры трудно регулировать. К тому же их механическая прочность и химическая устойчивость недостаточны. Поэтому все иониты изготовляют главным образом процессом полимеризации. Сетчатая структура полимера образуется при сополимеризации мономерного электролита или мономера, к которому впоследствии можно присоединить ионогенные группы, с мономером, имеющим две двойные связи и выполняющим поэтому функцию мостикообразователя. Соотношением основного компонента и мостикообразователя регулируют сетчатость сополимера и его набухаемость.
Примером сополимеризации мономеров, содержащих ионогенные группы, служат способы получения слабокислотного катионита сополимеризацией метакриловой кислоты с дивинилбензолом:
|
|
|

Присоединением ионогенных групп к сополимерам получают иониты разнообразных типов. Для этой цели чаще всего используют сополимеры стирола с дивинилбензолом. Если гранулы такого сополимера сульфируют, то получают сульфокатионит:
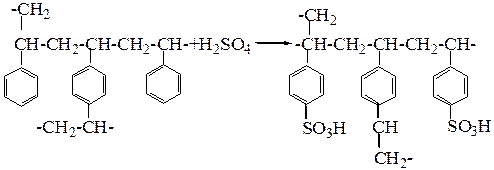
При обработке же сополимера трихлоридом фосфора получают фосфорнокислотный катионит, содержащий группы фосфинистой или фосфиновой кислоты:


Хлорметилируя сополимер хлорметиловым эфиром или смесью параформа и хлористого водорода, получают промежуточный продукт, который переводят в монофункциональный ионит любой основности:
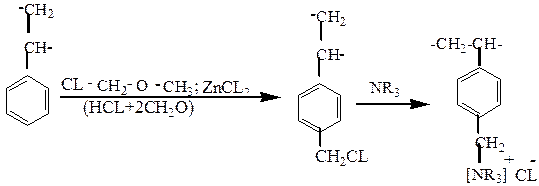
или в слабокислотный катионит:
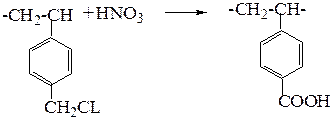
В сополимер стирола и дивинила вводят ионогенные группы, одновременно превращая его в сетчатый сополимер.
Присоединяя к звеньям полимеров сульфгидрильные группы, получают иониты, способные и к реакциям электронного обмена (окислительно-восстановительным реакциям); присоединяя одновременно кислотные и аминогруппы, придают ионитам амфотерные свойства; близким расположением в звеньях полимера ионогенных и полярных групп создают условия для образования комплексов с поглощаемым ионом:

Иониты в зависимости от их кислотного и основного характера могут реагировать как катиониты или как аниониты. Катиониты обладают способностью к обмену катионов своих ионогенных групп на катионы растворенных солей или водородные ионы кислот. В общем виде:

 R n (SO3 H) m R n (SO3) m … m H+
R n (SO3 H) m R n (SO3) m … m H+

 R n (SO3)– m … m H+ + m NaCl R n (SO3)– m … m Na+ + m HCl
R n (SO3)– m … m H+ + m NaCl R n (SO3)– m … m Na+ + m HCl
Пример катионного обмена:
1. Na-смола + CaSO4 ↔ Ca-смола + Na2 SO4
2. H-смола +CaSO4 ↔ Ca-смола + H2 SO4
3. Ca-смола + HCl ↔ H-смола + CaCl2
4. H-смола + NaCl ↔ Na-смола + HCl
5. H-смола + NaOH ↔ Na-смола + H2 O – реакция нейтрализации
Аниониты обменивают анионы своих ионогенных групп на анионы солей или кислот, находящихся в растворе. В общем виде:
 R n (NR3 + OH–) m ↔ R n (NR3)+ m … m OH–
R n (NR3 + OH–) m ↔ R n (NR3)+ m … m OH–
R n (NR3)+ m … m OH– + m NaCl ↔ R n (NR3)+ m … m Cl- + m NaOH
Пример анионного обмена:
|
|
|
1. ОН-смола + HCl ↔ Cl-смола + H2 O – реакция нейтрализации
2. SO4 -смола + NaOH ↔ OH-смола + Na2 SO4
3. Cl-смола +CaSO4 ↔ SO4 -смола + СaCl2
Подобные реакции имеют место и для обмена с многочисленными другими органическими и неорганическими солями, кислотами и основаниями. Реакции обратимы, что очень важно для регенерации ионита (перевод катионитов в Н-форму осуществляется соляной кислотой, а в нейтральную – раствором NaCl. Перевод же анионитов в ОН-форму происходит при обработке его раствором NaOH).
Благодаря двухступенчатому методу обмена можно достигать практически полного удаления электролита. Это так называемое обессоливание или деминерализация, протекает, например, для обычной воды с постоянной жесткостью по следующей схеме.
Для воды, содержащей CaSO4, процесс протекает по уравнению:
CaSO4 + H-смола = H2 SO4 + Ca-смола
Для воды, содержащей NaCl, имеет место следующая реакция:
NaCl + H-смола = HCl + Na-cмола
Удаление кислот идет по схеме:
H2 SO4 + OH-смола = SO4 -смола + НОН
HCl + OH-смола = Cl-смола + НОН
16.4. «Емкость» ионита
Обменная способность ионитов определяется встряхиванием их навески с титрованными растворами кислоты (или щелочи), а также фильтрованием этого раствора через слой ионитов, с последующим титрованием отфильтрованной пробы раствора щелочью (или кислотой). Обменная емкость ионитов обычно выражается в миллиграмм-эквивалентах поглощенного иона на 1 г (или единицу объема) ионита. Высокоемкие иониты могут поглощать 6–10 мг-экв иона на 1 г ионита.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 2703; Нарушение авторских прав?; Мы поможем в написании вашей работы!