
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приготовление реактивов
|
|
|
|
1) 1 %-ный раствор дифениламина в серной кислоте: 1 г дифениламина растворяют в 99 г концентрированной серной кислоты (плотностью 1,84). Это соответствует приблизительно 54 мл Н2SО4.
Расчет:
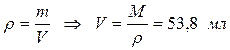 ,
,
где: r – плотность,
m – масса,
V – объем.
2) Исходный раствор NaNО3 для построения калибровочной кривой.
Если растворить 1 г NaNO3 в 1 л воды, то это будет соответствовать 729 мг/кг нитратов (по нитрат-иону):
85 – 1000 мг (1г)
62 – Х
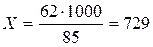 мг/кг
мг/кг
где: 85 – молекулярный вес NaNO3,
62 – молекулярный вес нитрат-иона (NО3–).
Однако, согласно табл. 1, наибольшее содержание нитратов в распространенных видах овощей – 3000 мг/кг.
729 – 1000 мг (1 г)
3000 – X
 ,
,
т. е. надо растворить 4,11 г соли в литре дистиллированной воды. Однако при небольшом количестве анализов в учебных целях достаточно и 100 мл, т. е. 411 мг NaNО3 нужно растворить в 100 мл воды.
Список литературы
1. С. А. Куценко Основы токсикологии – Санкт-Петербург, 2002 – Интернет – Медлайн.Ру – Российский Биомедицинский журнал
2. Поляков В. А. Экологическая взаимообусловленность мира. Учебное пособие для 6 – 11-х классов. Изд. 3-е, исправленное и дополненное. – Краснодар: Эдви, 1996, – с. 402.
3. Биология:Растения, бактерии, грибы, лишайники: Учеб. для 6 – 7 кл. обшеобразоват. учреждений / Т. И. Серебрякова, А. Г. Еленевский, М. А. Гуленкова и др. – 5-е изд. – М.: Просвещение, 1999. –224 с.: ил. – ISBN 5-09-008715-6.
4. Общая ботаника с основами геоботаники: Учеб. для биол. и геогр. спец. вузов / В.В. Петров, Л.И. Абрамова, С.А. Баландин, Н.А. Березина. – М.: Высш. шк., 1994. – 271 с.: ил. – ISBN 5-06-002580-2.
5. Федорова А.И., Никольская А.Н. Практикум по экологии и охране окружающей среды. – М.: ВЛАДОС, 2001.
6. Практикум по почвоведению /Под ред. проф. И. С. Кауричева – М.: Колос, 1973. – 279 с.
|
|
|
7. Химическое загрязнение почв и их охрана: Словарь-справочник / Орлов Д. С., Малинина М. С. и др. – М.: Агропромиздат, 1991. – 303 с. –ISBN 5-10-002334-1.
8. В. В. Худолей, И. В. Мизгирев Экологически опасные факторы – Санкт-Петербург: PUBLISHING HOUSE, 1996 – Интернет –Центр независимой экологической экспертизы.
9. Коробкин В. И., Предельский Л. В. экология: Учебник для студентов высших учебных заведений – Ростов н/Д: Феникс, 2001. – 576 с. – ISBN 5-222-01018-3.
10. Воронков Н.А. Экология общая, социальная, прикладная: Учебник для студентов высших учебных заведений. Пособие для учителей. – М.:Агар, 1999. – 424 с. ISBN5-89218-096-4
11. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов/Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. – 2-е изд., испр. и доп. – М.: Высш. шк., 2000 – 560 с.: ил. ISBN 5-06-003626-Х
12. Экологическая химия / под ред. Ф. Корте. – М.: Мир, 199
13. Шустов С.Б., Шустова Л.В. Химические основы экологии. – М.: Просвещение, 1995
14. Беспамятнов Г.П., Кротов Ю.А. Предельно-допустимые концентрации химических веществ в окружающей среде. – Л.: Химия, 1985
15. Исидоров В.А. Введение в химическую экотоксикологию. – СПб.: Химиздат, 1999
16. Фелленберг Г. Загрязнение природной среды. – М.: Мир, 1997
Приложение
Приготовление водной вытяжки
Химические свойства почв изучают, предварительно приготовив водные вытяжки. Для этого отвешивают на технохимических весах 100 г воздушно-сухой почвы, просеянной через сито с отверстиями 1 мм, переносят ее в пол-литровую колбу и приливают 500 мл дистиллированной воды, лишенной CO2. Закрывают колбу пробкой, взбалтывают содержимое 3 минуты и вытяжку отфильтровывают через фильтр из плотной бумаги. Чтобы фильтрат был прозрачным, на фильтр переносят часть почвы. Если первые порции фильтрата мутные, то их снова выливают на фильтр. Для анализа собирают только прозрачный фильтрат. По окончании фильтрования колбу закрывают пробкой, чтобы исключить возможность испарения фильтрата, а также уменьшить его загрязнение различными газами (NH3, пары HCl и другие), которые могут находиться в лаборатории.
|
|
|
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 705; Нарушение авторских прав?; Мы поможем в написании вашей работы!