
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость энтальпии веществ и тепловых эффектов химических реакций от давления
|
|
|
|
При рассмотрении зависимости энтальпии от давления воспользуемся хорошо нам известным выражением ее полного дифференциала (III, 27):
dH = VdP + TdS
Разделим его на dP при условии постоянства температуры
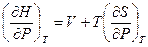 (V, 29)
(V, 29)
Теперь, если принять во внимание соотношение Максвелла (III, 38), согласно которому  и подставить его в (V, 29), то получим:
и подставить его в (V, 29), то получим:
 (V, 30)
(V, 30)
Если обе части последнего уравнения умножить на dP и проинтегрировать от Р = 1 атм. до Р при T = const, то это позволит определить абсолютную энтальпию вещества
 или
или 
Аналогичное выражение можно записать для теплового эффекта химической реакции:
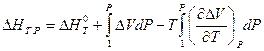
где  — тепловой эффект химической реакции при стандартных условиях, а D V — изменение объема системы в результате реакции.
— тепловой эффект химической реакции при стандартных условиях, а D V — изменение объема системы в результате реакции.
Теплоту реакции при любом давлении можно вычислить из полученного уравнения, если экспериментальные данные позволяют вычислить интегралы в его правой части.
Однако на практике поступают иначе. Запишем выражение для коэффициента сжимаемости: 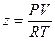 .
.
После дифференцирования z по температуре T при постоянном давлении (P = const) получаем:
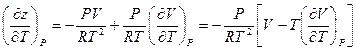
Или после очевидных преобразований:

Если теперь полученное выражение подставить вместо правой части уравнения (V, 30), то окончательно имеем:
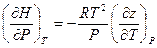 (V, 31)
(V, 31)
Принимая во внимание, что T=Tкрит. ´ t и P=Pкрит. ´ p (так как 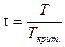 и
и  ), соотношение (V, 31) можно выразить через приведенные температуру и давление:
), соотношение (V, 31) можно выразить через приведенные температуру и давление:

Интегрирование последнего уравнения от стандартного состояния до состояния при любом давлении после простых преобразований дает следующий результат:
 (V, 32)
(V, 32)
Решение уравнения (V, 32) дается в виде графиков или таблиц. Функция  зависит от приведенных температуры, давления и zкрит.. Её значение позволяет учесть изменение энтальпии с изменением давления, а затем рассчитать тепловой эффект химической реакции при заданных условиях по уравнению:
зависит от приведенных температуры, давления и zкрит.. Её значение позволяет учесть изменение энтальпии с изменением давления, а затем рассчитать тепловой эффект химической реакции при заданных условиях по уравнению:
|
|
|
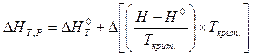
[1]Все сказанное выше относительно испарения действительно и для процесса возгонки (сублимации).
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1189; Нарушение авторских прав?; Мы поможем в написании вашей работы!