
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Рассмотрим примеры решения задач
|
|
|
|
Задача 1. Вычислите молярную массу эквивалента металла в оксиде, содержащем 52% металла. Назовите этот металл, если он шестивалентен в данном оксиде. Составьте формулу оксида.
Решение: 100 – 52 = 48% кислорода в оксиде.
По закону эквивалентных отношений записываем выражение:

m (Me) = MЭ (Ме)∙В = 8,66∙6 = 52 г/моль
Шестивалентным металлом с атомной массой 52 а.е.м. является хром. Его оксид CrO3.
Задача 2. На восстановление 7,09 г оксида металла требуется 2,24 л водорода (н.у.). Вычислите молярную массу эквивалента металла и его оксида.
Решение.
На основании закона эквивалентных отношений записываем выражение:
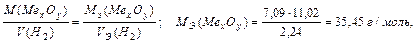
MЭ (Ме xОy) = MЭ (Ме) +MЭ (О); (МЭ (О)=8 г/моль), тогда
MЭ (Ме) = 35,45 – 8 = 27,45 г/моль.
Задача 3. Из 3,85 г нитрата металла Me(NO3)x получено 1,60 г его гидроксида Me(OH)x. Вычислите эквивалентную массу металла.
Решение.
На основании закона эквивалентных отношений записываем выражение:


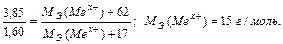
Задача 4. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л Н2 (н.у.). Вычислите молярную массу эквивалента и молярную массу металла. Назовите металл.
Решение.
Используя закон эквивалентных отношений, запишем выражение:

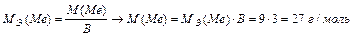
Металл – алюминий.
Знание закона эквивалентных отношений необходимо для:
1. химических расчетов и идентификации веществ.
2. определения молярной концентрации эквивалентов вещества в растворе и использование полученных расчетов в объемном анализе.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 377; Нарушение авторских прав?; Мы поможем в написании вашей работы!