
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая кинетика
|
|
|
|
Энергия Гельмгольца химической реакции равна разности между суммами энергий Гельмгольца продуктов реакции и энергий Гельмгольца исходных веществ, с учетом стехиометрических коэффициентов.
DFх.р. = SDF0прод. - SDF0исх.в-в, с учетом стехиометрических коэффициентов.
Для изобарно-изотермических условий I-ый закон термодинамики можно записать в виде: QP = DU + РDV; т.е.теплота при изобарно-изотермических условиях равна изменению энтальпии QP = DU + pDV = DH (при условии, что не совершается никакой иной работы, как против давления). Объединяя неравенство D S ³ QP/T (выражение II закона термодинамики), получим вид: DН - ТDS £0. Если выражение DН - ТDS обозначить через новую термодинамическую функцию состояния – свободную энергию Гиббса, DG:
DН - ТDS = DG,
следовательно II –е начало термодинамики, применительно к изобарно-изотермическим процессам можно записать так: DG £0. G – энергия Гиббса, является также как и энергия Гельмгольца лишь балансом все тех же двух критериев самопроизвольного протекания процессов: выделения теплоты и возрастания энтропии. Итак,
1. для изобарно-изотермических условий DG является суммарным критерием самопроизвольного протекания процессов DG = DН - ТDS (объединенный (I и II) закон термодинамики).
2.Процессы, в которых DG убывает (DG< 0) протекают самопроизвольно.
D G < 0, химические процессы могут идти самопроизвольно;
DG = 0, химические процессы занимают пограничное (равновесное) положение;
DG > 0, химические процессы сами проходить не могут.
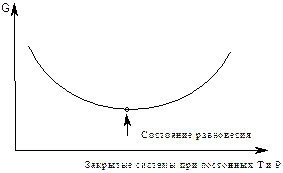 |
DG £ 0 DG £ 0
DG = 0
рис.11
3. Энергия Гиббса DG является функцией состояния системы, поэтому вычислить изменение энергии Гиббса химических реакций можно по следствию из закона Гесса. Энергия Гиббса химических реакций равна разности между суммами энергий Гиббса продуктов реакции и энергий Гиббса исходных веществ, с учетом стехиометрических коэффициентов.
|
|
|
DGх.р= SDG0прод. - S DG0исх..в-в., с учетом стехиометрических коэффициентов.
DG0обр. (Х) – стандартная энергия Гиббса вещества Х при стандартных условиях и в определенном агрегатном состоянии.
DG0сг. (Х) – стандартная энергия сгорания вещества – это DG реакции окисления до конечных оксидов 1 моля Х. Для простых веществ и элементов DG0обр.(Х) (как и DН0обр.(Х)) равны нулю.
Задача: Спиртовое брожение происходит по уравнению реакции:
С6Н12О6(ж) ® 2С2Н5(ОН)(ж) + 2СО2(г)
DG0обр, кДж/моль -915 -174 -394
Решение:
DG0х.р. = 2(-174) + 2(-394) – (-915)= -221 кДж/моль
DН0х.р. этого процесса составляет –79 кДж/моль. Следовательно, за счет энтропийного вклада способность брожения совершать полезную работу увеличивается почти втрое. Это очень важно, так как подобные процессы служат важнейшим источником энергии как у многих так называемых анаэробных организмов, так и у животных и человека при интенсивной мышечной нагрузке.
4. Функция G называется энергией, так как определяет работоспособность соответствующего процесса. А именно, DG численно рана полезной максимальной работе, которая могла бы быть совершена в ходе изобарно-изотермического процесса.
План
1. Гомогенные и гетерогенные химические процессы.
2. Факторы, влияющие на скорость химических реакций.
2.1 природа реагирующих веществ;
2.2 концентрация (давление). Закон действия масс.
2.3 температура. Правило Вант-Гоффа. Уравнение Аррениуса.
Энергия активации.
2.4 катализатор.
3. Химическое равновесие. Константа равновесия.
4. Смещение равновесия. Принцип Ле-Шателье.
Литература:
1. Фролов В.В. Химия. Гл.V, §51-56.
2. Лучинский Г.П. Курс химии. Гл.V, §8-12, гл. VI, §13-18
3. Ахметов Н.С. Общая и неорганическая химия. Раздел V, гл.3,4.
|
|
|
4. Общая химия под ред. Соколовской Е.М. и др. Гл.6, §1-11.
Химическая термодинамика изучает возможность, направление и пределы самопроизвольного протекания химических процессов. Однако механизм и скорость процессов в химической термодинамике не рассматриваются. В то же время представление о скорости химических реакций и факторах, влияющих на нее, исключительно важно для управления химическими процессами. Область химии, изучающая механизм химических реакций и скорость их протекания, называется химической кинетикой.
Химические реакции могут протекать с различными скоростями. Одни из них протекают мгновенно: 2H2 + O2 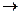 2H2O, другие протекают в течение нескольких секунд, минут:CuSO4 + 2NaOH
2H2O, другие протекают в течение нескольких секунд, минут:CuSO4 + 2NaOH 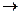 Na2SO4+Cu(OH)2, FeCl3 + 3NaOH
Na2SO4+Cu(OH)2, FeCl3 + 3NaOH 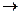 3NaCl+Fe(OH)3.
3NaCl+Fe(OH)3.
Биологические реакции могут длиться годы, десятилетия, а превращение древесины в уголь происходит в течение столетий, тысячелетий. При изучении скорости химических реакций необходимо различать гомогенные и гетерогенные реакции.
Гомогенные реакции – это такие реакции, в которых исходные вещества и продукты находятся в одинаковых агрегатных состояниях: газообразном (г) или жидком (ж), или твердом (т) и не имеют между собой поверхности раздела.
Гетерогенные реакции – это такие реакции, в которых исходные вещества и продукты реакции имеют между собой поверхность раздела и находятся в различных агрегатных состояниях.
В химической кинетике различают мгновенную (или истинную) скорость и среднюю скорость.
Мгновенная скорость химической реакции определяется первой производной концентрации по времени.
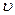 мгн
мгн 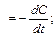 С - концентрация реагирующих веществ (моль/л);
С - концентрация реагирующих веществ (моль/л);
t –время реакции, с.
Средняя скорость реакции 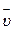 равна изменению концентрации (DС) реагирующих веществ за определенный промежуток времени (Dt):
равна изменению концентрации (DС) реагирующих веществ за определенный промежуток времени (Dt):
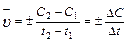
Размерность скорости реакции моль/л .с.
Скорость гомогенной реакции определяется как количество вещества (n) вступившего в реакцию или образовавшегося в результате химической реакции за единицу времени в единице объема:
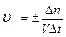 ; n – число молей участвующих в реакции;
; n – число молей участвующих в реакции;
V – объем (л);
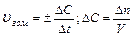 - молярная концентрация (моль/л).
- молярная концентрация (моль/л).
Скорость гетерогенной реакции – это количество вещества вступившего в реакцию или образовавшегося в результате ее за единицу времени на единице площади поверхности фазы:
|
|
|
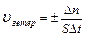 ;
; 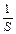 - единица площади поверхности фазы.
- единица площади поверхности фазы.
Факторы, влияющие на скорость химической реакции:
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 473; Нарушение авторских прав?; Мы поможем в написании вашей работы!