
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЛЕКЦИЯ. Реакторлар 5 страница
|
|
|
|
Аммиак өндірісін жетілдіру. Аммиак өндірісін өнеркәсіптік жетілдіру келесі негізгі бағыт бойынша жүреді:
- мұнайды өндеу газдары мен табиғи газды пайдалану базасында негізгі органикалық синтез өндірісімен аммиак өндірісінің кооперациясы;
- (3000 т/тәулік. дейін) үлкен қуат бірлігіндегі агрегаттарды құру;
- қайнау қабаты катализатор синтезі колоннасын қолдану;
- уларға төзімді, жану (300 0С) температурасы төмен, синтез процесін төменгі қысымды (10 мПа) аммиак шығымын азайтпай жүргізуге мүмкіндік беретін жаңа катализаторды жасау.
Бақылау сұрақтары.
1. «Байланысқан» азоттың басты мәселесі неде?
2. «Байланысқан» атмосфералық азотты өндіру әдістерін атап көрсет және олардың энергия сиымдылығы мен эффектілерін салыстырыңыз.
3. Аммиак және оның ерітінділерінің қолданыс аймақтарын атап өт.
4. Соңғы жылдары аммиакті өндіру шикізат құрылымы неге және қалай өзгерді?
5. Аммиакты өндіруде метандау дегеніміз не?
6. Аммиак өндіруде неге циклдық үлгі қолданылады?
7. Аммиак өндіру үшін контактті массаны қалай аламыз? Не үшін оған алюминий, калий, және кальций оксидтері енгізіледі?
8. Аммиакты өндіруде орташа қысым жүйесі не себептен кең көлемде қолданылады?
9. Синтездеу колоннасында оңтайлы температуралық режим не арқылы қамтамасыз етіледі?
№10 ЛЕКЦИЯ. Күкірт қышқылын өндіру
Күкірт қышқылының түрлері, қасиеттері мен пайдалану аймақтары
Күкірт қышқылы кең таралған көп мөлшерде пайдаланылатын зат (тауар). Мысалы, 2001 жылы дүниежүзінде шамамен 140 млн.т. Н2SO4 өндірілген. Оның жартысына жуығы минералды тыңайтқыштар өндіруге қолданылды.
|
|
|
Өндіріс технологясын, аппараттарын, жаңа үлгілерді жетілдіру арқылы өнім әрбір жүйеде жылына 120-360 мың тонна (колчедан), 100-500 мың тоннаға (күкірт) дейін өсті. Өндірістің техника – экономикалық көрсеткіштері: шикізатты толық пайдалану, құрылысқа меншікті капитал және эксплуатация (пайдалану) шығыны, экология және т.б. жақсарды.
Өндірістен шығатын газдағы күкірттің диоксидын бұрыңғымен салыстырғанда 8-10 есе азайды. Күкірт қышқылы туралы деректер біздің эрамыздың 940 жылынан бері мәлім (персия алхимигі Абу-Бекр-Альрасес еңбектері).
Күкірт қышқылын ертеде темір сульфатын (купоросын) құрғақ айдау арқылы алған. Сондықтан да шоғырланған күкірт қышқылын купорос майы деп атаған.
Англияда 1746 жылы күкірт пен селитраны қорғасын аппаратта (камера) күйдіріп күкірт қышқылын алу жолы өндіріске ендірілген. Кейін бұл технология жетілдіріліп, жаңа әдіс – камералық нитроза, мұнаралы тәсіл деп аталын болды.
1831 жылы ағылшын ғалымы Филипс күкірт қышқылын алудың жаңа тәсілі – контакт әдісін ұсынды. Катализатор арқылы күкірттің диоксидын үшоксидке дейін тотықтырып, кейін сумен реакцияға түсіру арқылы күкірт қышқылын алатын болған.
Сусыз күкірт қышқылының құрамы Н2О×SO3 = 81,63% SO3, 18,37% Н2О. Егер 1 моль SO3 келетін су 1 мольден көп болса, оны күкірт қышқылының ерітіндісі, ал 1 моль SO3 келетін су 1 мольден кем болса, онда оны олеум (түтінденіп тұратын) деп атайды.
Күкірт қышқылы орта және қышқыл тұздар түзетін күшті қышқыл. Жоғары шоғырлы күкірт қышқылының тотықтыру қасиетін күкірттің валенттігін төмендеті арқылы іске асырады. Тотықсыздандыратын затқа байланысты күкірт қышқылы SO2, S, H2S дейін тотықсызданады. Мысалы: Сu+2Н2SO4(конц)= СuSO4+SO2+2H2O
|
|
|
Күкірт қышқылы мырышпен реакцияға түскенде концентрация мен температураға байланысты ZnSO4 – мен бірге SO2, S, H2S болуы мүмкін. Сұйытылған күкірт қышқылы тек активті металдарды тотықтырады (Н2-ге дейін тұрған металдар). Мысалы:
Zn+ Н2SO4=ZnSO4+H2
Бұл жерде реакция сутек ионның тотықсыздануы арқылы жүреді. Темірді күкірт қышқылымен жуып, тотықтан тазалайды.
FeO+ Н2SO4=FeSO4+H2O
Темір, алюминий сульфаттарын коагулянт, ал мыс сулфатын – минералды бояу ретінде, өсімдік ауруларымен күресу үшін қолданады. Қос сульфаттарды [КАI(SO4)2] - теріні бояуда, өңдеуде, лак өндірісінде қолданады. Күкірт қышқылын басқа қышқылыдарды өндіруде қолданады. Мысалы:
Са3(PO4)2 + 3H2SO4 = 3CаSO4+2H3PO4
NaNO3 + H2SO4= HNO3+NaHSO4
2NаСI + H2SO4= 2HСI+Na2SO4
СаF2 + H2SO4= 2HF+CаSO4
Са5(PO4)3F+5H2SO4=3H3PO4+5CaSO4+НҒ
Жоғары шоғырлы күкірт қышқылын газдарды су буынан тазалау үшін де қолданады. Күкірт қышқылын органикалық өндірісте кеңінен пайдаланады. Мысалы, вискоз жіптерін алу сатыларының бірінде күкірт қышқылымен целлюлоза ксантогенатын ыдыратады. Олефиндерді күкірт қышқылымен өңдеп, соңынан гидролиздеу арқылы спирт алады. Мысалы, этил спиртін этиленнен алғанда:
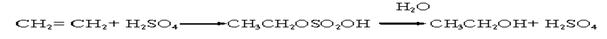
Ароматты қосылыстарды күкірт және азот қышқылдарымен өңдеп неше түрлі нитроқосылыстар алады. Оларды жарылғыш заттар, дәрі, бояу, тамақ т.б. заттар өндірісінде пайдаланады. Органикалық заттарды күкірт қышқылымен өңдеу арқылы түрлі бояу, дәрі, ал майлы органикалық қатардан кір жуғыш заттар алады. Қолданылуына байланысты күкірт қышқылы сорттарына талаптар әртүрлі. Мысалы, вискоза өндірісінде пайдаланатын күкірт қышқылында темір 0,015%-тен 0,03% көбейсе, онда фильтрация жылдамдығы 7-8 есе кемиді, заттың сапасы (жіптің мықтылығы және т.б.) төмендейді.
|
|
|

Сурет 3.1. Күкірт қышқылын пайдалану аймақтары.
Кесте 3.1
Тауарлы күкірт қышқылының сапасына қойылатын талаптар
| Сорт | Конц. н.м. % | Қоспалардың мазмұны, % | |||||||
| H2SO4 | SO3 | N2O3 | Så | As | Хлорид Ñl | Күйдіру шынысы | Ðb | ||
| Контакт қышқылы ГОСТ 2184-77 Жоғарғы сорт | 92,5 | - | 5×10-5 | 0,007 | 8×10-5 | 1×10-4 | 0,02 | 1×10-3 | |
| Жақсартылған 1-ші сорты | -94 | - | 1×10-4 | 0,015 | 1×10-4 | 5×10-4 | 0,03 | 1×10-3 | |
| Техни калық | 1øi с. | 92,5 | - | - | 0,02 | - | - | 0,05 | - |
| 2øi с. | 92,5 | - | - | - | - | - | - | - | |
| Олеум жақсартылған ж.с. | - | 2×10-4 | 0,007 | 8×10-5 | - | 0,02 | 1×10-4 | ||
| 1ші ñ. | - | 5×10-4 | 0,01 | 1×10-4 | - | 0,03 | - | ||
| Îëåóì òåõíèêàëûқ | - | - | - | - | - | - | - | ||
| аккумуляторлық 667-73 36 1ші с. | - | 3×10-5 | 0,005 | 5×10-5 | 2×10-4 | 0,02 | 0,01 | ||
| - | 5×10-5 | 0,006 | 5×10-5 | 3×10-4 | 0,03 | 0,01 |
Тасымалдау кезінде күкірт қышқылы қатып қалмауы үшін мемлекеттік стандарт бойынша қышқылдың концентрациясы төмендегідей болуы қажет:
Кесте 3.2
| Áàөàíàëûқ (ì½íàðà) қûøқûë | % H2SO4 | % SO3(á) | tкр,0C |
| - | -29,5 | ||
| Êîíòàêòû қûøқûë | 92,5 | - | -22,0 |
| Îëåóì | 104,5 | +2 | |
| Æîөàðû êîíö. îëåóì | 114,6 | -0,35 |
Техникалық қышқылдардың кристаллизация температурасы tкр таза қышқыл tкр төмен. Қышқылдағы қоспалар көбейген сайын бұл әсер арта түседі де, tкр-төмендей береді.
3.1.2 ӨНІМ ЖӘНЕ ШИКІЗАТТАР СИПАТТАМАЛАРЫ
Күкірт қышқылы және олеум
| Молекулалық массасы | 98,078 |
| Тығыздық, (20 0С), г/см3 | 1,8305 |
| Балқу температурасы (100% Н2SО4) | 10,37±0,05 |
| Қайнау температурасы, 0С (100%) | 275±5 (ыдырайды) |
| 98,479% | 326±5 (макс) |
Жылу сыйымдылығы (250С), кДж/кг×град:
98,5% 1,414
99,22% 1,405
99,97% 1,412
100,39% 1,394
Газ түріндегі Н2SО4 жылу сыйымдылығы (Дж/моль×град):
Ср=4,19(7,86+46,15×10-3×Т-26,12×10-6×Т2 (3.1)
|
|
|
Термиялық диссоциация Н2SО4↔ SО3+Н2О-Q
Реакция жылуы:
Q=4,19(-26,375+13,34×Т-18,795×10-3×Т2+0,8704×10-5×Т3-3,22×10-5×Т-1

P – қысым, атм.
Атмосфералық қысымдағы диссоциация дәрежесі, х:
| T, OC | ||||
| X, % | 10-5 | 2,5 | 27,1 | 69,1 |
Кесте 3.3
Түзілу жылуы және бос энергия өзгеруі (изобарлық потенциал):
| -ΔН кДж/моль | -ΔG КДж/моль | |
| Sқ.ромб. + Н2г +2О2г = Н2SО4сұйық | 812,483 | 687,579 |
| Sқ.ромб. + Н2г +2О2г = Н2SО4сұйық ерітінді | 908,81 | 739,703 |
| Sқ.ромб. +2О2г+2ē = SО42- | 908,81 | 739,703 |
| Sқ.ромб. +2О2г+1/2 Н2г +ē= НSО4- | - | 750,68 |
| SО2г + Н2Осұйық +1/2О2 = Н2SО4сұйық | 228,69 | - |
| SО3г + Н2Осұйық = Н2SО4сұйық | 130,56 | - |
| SО3г + Н2Ог= Н2SО4г | 95,364 | 52,375 |
| SО3сұйық + Н2Осұйық = Н2SО4сұйық | 88,744 | - |
| Н2SО4сұйық = Н2SО4г | -79,19 | - |
Күкірт қышқылының массалық пайызын -П 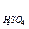 % десек
% десек
Í2SO4= Í2Î+SO3(байл), Í2Î= 0,1837× Í2SO4, SO3(байл)=0,8163× Í2SO4
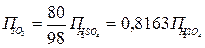 керісінше
керісінше 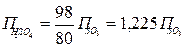 (3.5)
(3.5)
Олеумде SO3 бос және сумен байланысқан түрінде (Н2SO4) болады.
Жалпы SO3 - П  , ал бос SO3 - П
, ал бос SO3 - П 
П 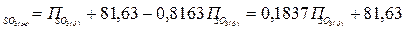 (3.6)
(3.6)
 (3.7)
(3.7)
Сусыз күкірт қышқылы 200С түссіз майлы сұйық, 10,370С кристалданып, қатты затқа айналады. 0,98×105Па және 296,20С сұйық күкірт қышқылы қайнайды да, шоғыры 98,3% Н2SO4 және 1,7% Í2Î жеткенде 336,50Ñ қайнайтын азеотропты қоспадан тұрады.
Кесте 3.4 Күкірт қышқылының кристалдану температурасы.
| Қосылыс | Н2SO4 % | SO3(ж), % | SO3(б), % | Tкр, , 0Ñ |
| Н2SO4×8,883Н2О | 31,02 | - | -72,2 | |
| Н2SO4×4Н2О | 57,6 | 46,9 | - | -28,36 |
| Н2SO4×2Н2О | 73,2 | 59,8 | - | -39,6 |
| Н2SO4×1815Н2О | 61,22 | - | -29,5 | |
| Н2SO4×Н2О | 84,5 | 69,0 | - | +8,48 |
| Н2SO4×0,39Н2О | 93,3 | 76,16 | - | =27 |
| Н2SO4 | 81,63 | - | +10,37 | |
| Н2SO4×SО3 | 110,1 | 89,9 | 44,95 | +38,15 |
| Н2SO4 | 104,05 | 84,94 | -2,8 | |
| Н2SO4×2SО3 | 113,9 | 93,0 | +1,2 |
Шамамен будағы және сұйық қышқылдағы Н2SO4 концентрацияларының арақатынасы былайша есептеледі.
 Сr, Сж- Н2SO4 % (3.8)
Сr, Сж- Н2SO4 % (3.8)
t = 100-2500C
күкірт қышқылы буының ерітіндісі бетіндегі парциалды қысымын төмендегі теңдеумен есептейді:
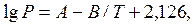 Р-Па (3.9)
Р-Па (3.9)
Кесте 3.5
| % Н2SO4 | |||||
| À | 7,751 | 7,897 | 8,17 | 8,316 | 8,47 |
| Â |
Кесте 3.6. күкірт қышқылы ерітіндісінің бетіндегі будың жалпы қысымы (Н2O, Н2SO4, SO3), (6) теңдеумен есептеледі, тек
| Н2SO4 % | 98,5 | ||||||||
| À | 8,925 | 8,832 | 9,032 | 9,034 | 9,293 | 9,255 | 9,79 | 9,78 | 9,805 |
| Â |
Кесте 3.7. Олеум үшін
| % SO3(б) | ||||||||
| À | 8,51 | 9,01 | 9,47 | 9,84 | 10,44 | 10,70 | 10,5 | 9,89 |
| Â |
Температура 2500С жоғарылағанда, будағы күкірт қышқылы (Í2SO4) ыдырап(Í2SO4«SO3 + Í2Î) SO3(á) және Í2Î буына бөлінеді. Бұл ыдыраудың (реакцияның) тепе-теңдік константасы:
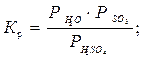
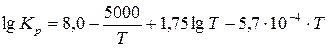 (3.10)
(3.10)
бұл жерде Р-Па, Т-К.  (3.11)
(3.11)
Күкірт қышқылын өндіруде қолданылатын шикізаттар. Күкірт қышқылын өндіру үшін шикізат ретінде элементарлы күкірт немесе элементті күкітртті бөліп алуға, күкірт диоксидын алуға болатын құрамында күкірт бар заттар қолданылады. Тума күкірттің табиғи кендері өте сирек кездеседі де, негізінен күкірт табиғатта темірмен, мырышпен, қорғасынмен, мырышпен, қорғасынмен, мыспен және т. б. Металдармен қосылыс ретінде кезеседі. Кейбір минералдарда күкірт екі металмен қосылыс түрінде кездеседі, мысалы, мыс колчеданы (халькопирит) күкіртің темір және мыспен қосылысы болып табылады. Табиғатта күкірт сульфаттар түрінде де кездеседі, мысалы, гипс (кальций сульфаты), мирабилит (натрий сульфаты), глауберит (натрий мен калцийдің сульфаты), мирабилит (натрий сульфаты), глауберит (натрий мен калцийдің сульфаты) және т. б. Жер қыртысындағы күкірттің жалпы мөлшері 0,1%. Сонымен бірге күкірт мұнайда, тас көмірде, жолайы және табиғи газда да болады.
Тас көмірден кокс алғанда оның құрамындағы күкірт коксты газдың құрамына кіретін күкіртсутегіне айналады. Күкіртсутегі генераторлы газдарда, мұнай өңдеу газдарында, жолайы мұнай газдарында және кейбір кен орындарында табиғи газдарында да кездеседі де, қажетсіз қоспа болып саналады. Метталлургиялық пештердің тастанды газдарында күкірт диоксиді едәуір мөлшерде кездеседі.
Көмірді ЖЭО (ТЭЦ), электр станцияларының оттықтарында және қазандық қондырғылрада жаққанда күкірт тотық түрінде оттық газдармен шығарылады. Жағынды газдарды тазалағанда бөлінетін күкірт сутегі және тастанды оттық газдардағы күкірт диоксидін күкірт қышқылын өндіруде қолданылады.
Көмірмен бірге темір (күкірт) колчеданы және көмірлі колчедан да алынады. Күкірт қышқылын өндіру үшін көмірлі колчедан да шикізат ретінде қолданылуы мүмкін. Осы мақсатпен күкірт қышқылын қолданатын өндірістердің қалдықтарын да пайдалануға болады. Оларға, мысалы, фосфогипс т. б. жатады.
Табиғи күкірттің қорларының шектеулігіне байланысты соңғы жылдардың өзекті мәселелерінің бірі табиғи газдағы, мұайдағы, қатты отындағы, сонымен бірге қара және түсті метталургияның шикізаттарындағы күкіртті пайдалану болып саналады.
Колчедан. Күкіртті колчеданның негізгі құрамдас бөлігі болып пирит минералы және марказит түрінде (минералдың құрамы бірдей, бірақ кристалдарының формасы басқа) кездесетін темір сульфиді Fe S2 (53,44 % және 46,56 % Fe) саналады. Табиғи күкіртті колчеданның құрамында Fe S2 – ден басқа мыс, мырыш, мышьяк, никел, клбальт, селен, висмут, теллур, кадмий қосылыстары, кальций мен магний карбонаттары мен сульфаттары, аз мөлшерде алтын мен күміс т. б. болады. Колчедан құрамында мыс CuFeS (мыс колчеданы) Cu2S (мыс жылтыры) және CuS түрінде; мырыш негізінен
ZnS түрінде мышьяк FeAsS (мышьякты колчедан) түрінде кездеседі. Құрамында пиритпен қатар түсті металдардың қосылыстарының едәуір мөлшері кіретін кендер полиметалдар деп аталады.
Күкірт колчеданы – сары немесе сары – сұр түсті минерал, оның тығыздығы шамамен 5000 кг/м3. Кесектерінің өлшемдері мен колчеданның сортына байланысты оның тығыздығы 2200 – ден 2400 кг/м3. дейін құрайды.
Колчеданның кендері Урал мен Кафказда, Испанияда, Жапонияда, Португалияда, Италияда, Норвегияда және басқа да елдерде бар.
Рудниктердің 50-400 мм түрінде алынатын колчеданды кәдімгі немесе қатардағы колчедан деп атайды.
Түрлі металдарды бөліп алу үшін колчеданды флотация арқылы өңдейді. Флотациялау процесі кеннің құрамына кіретін минералдардың кейбіреулері сумен жақсы суланып, кейбіреулерінің нашар немесе тіпті суланбауына негізделген. Суға түрлі химиялық заттарды (флотореагенттерді) қосқанда суланғыштық қасиеті өзгереді. Осы қасиеті минералдарды бөлу үшін пайдаланылады. Өте майдаланған кендердің сулы көбігі (пульпа) арқылы ауа үрлейді. Осы кезде сумен суланбайтын (гидрофобты) кеннің бөлшектері ауа көпіршіктеріне қабысып бетіне жүзіп шығады, ал сумен суланған бөлшектері (гидрофильді) аппараттың түбіне құрамында түсті металдың азайған мөлшері бар флотациялық колчедан түрінде шегеді. Ауа көпіршіктернен құралған көбікті құрамында түсті металдар бар минерал бөлшектерімен қоса сұйықтық бетінен алып, тұндырғыштарға жібереді, онда көбік қиралады да бөлшектер сәйкес концентрат (мысты, мырышты және т. б.) түзеді. Сәйкес флотореагенттреді таңдау арқылы кеннің маңызы бар барлық құрамдас бөлшектерін ажыратып алады. 100 т колчеданнан 80-85 т флотациялық колчедан және 15 – 20 т концентрат алады. Түрлі кен орындарына байланысты мыс және мырыш кендерінің құрамы едәуір аралықта өзгереді. Флотация кезінде сирек және шашыранды элементтерді бөліп алу натижесі төменде келдтірілген:
Бөліп алу нәтижесі, % жоғары емес
Ca 10
Se, Te, Ti, Ce 40
Zn, Cd, B 85
Флотациялық колчедан құрамындағы күкірттің мөлшері 32-ден 40%- ке дейін өзгеріп отырады. Осы колчеданды екіншілей флотациялап, бос жынысты бөліп алғаннан кейін құрамында 45 – 50 % S бар пиритті концентрат алынады. Қазіргі кезде алынатын колчеданның барлығы дерлік флотацияланады. Флотациялық колчеданды өндірудің технологиялық үлгісі сурет 4 көрсетілген.
Магнитті колчедан немесе пироттин, темірдің күкіртпен 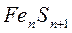
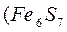 -ден
-ден 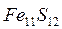 дейін) формуласына сәйкес күрделі құрамды қосылысы. Көбінесе пирротиннің қоспалары болып мыс, никель және кобальт табылады. ТМД елдерінде пирротиндер едәуір мөлшерде Кафказда, Уралда, Сібірде, Канадада, Норвегияда және басқа да елдерде кездеседі.
дейін) формуласына сәйкес күрделі құрамды қосылысы. Көбінесе пирротиннің қоспалары болып мыс, никель және кобальт табылады. ТМД елдерінде пирротиндер едәуір мөлшерде Кафказда, Уралда, Сібірде, Канадада, Норвегияда және басқа да елдерде кездеседі.
|
|
|
|
|
Дата добавления: 2014-12-10; Просмотров: 2040; Нарушение авторских прав?; Мы поможем в написании вашей работы!