
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Шымкент, 2014 2 страница

Мұндағы А-тұрақты шама. Бұл теңдеудегі "Е" екі жолмен анықгауға болады.
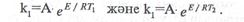
|
І.Екі температурадағы жылдамдықконстанталары бойынша
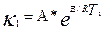 және
және 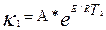
Осы екі теңдеуді өзара біріктіріп шешетін болсақ, онда:

Ордината өсі бойымен 1 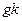 мәнін, абсцисса өсі бойымен температураның кері мәнімен алатын болсақ, онда алынған түзу сызықтық абсцисса өсімен қиылысу бұрышының тангенсі.
мәнін, абсцисса өсі бойымен температураның кері мәнімен алатын болсақ, онда алынған түзу сызықтық абсцисса өсімен қиылысу бұрышының тангенсі.
- 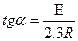 - шамасын, ал ордината өсімен қиылысу нүктесімен
- шамасын, ал ордината өсімен қиылысу нүктесімен
координаталар басталатын нүкте аралығы "lgА" береді. (Олардан "Е" және "А" табу қиын емес). (1-сурет).

Қарапайым реакциялар үшін мономолекулярлы реакциялар-бірінші ретті, бимолекулярлы-екінші ретті болады. Ал күрделі реакциялардың молекулярлығы мен реті сәйкес келе бермейді.
Химиялық реакция ретін анықтау үшін жылдамдықтың концентрацияға тәуелділігін керсететін теңдеуді, жартылай мерзімін немесе графиктік әдісті қолданады.
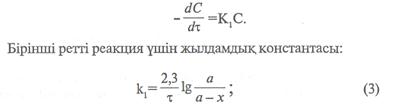
|
Мұндағы «а» -заттың алғашқы мөлшері, моль/л, х – уақыттың ішінде заттың реакцияға түскен мөлшері, моль/л. (а-х)-уақыттағы заттың реакцияға түспей қалған мөлшері, моль/л. Екінші ретті реакциялар үшін кинетикалық тендеу формуласы:

Мұңдағы 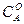 және
және 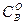 "А" және "В" заттарының бастапқы концентрациялары. Егер "
"А" және "В" заттарының бастапқы концентрациялары. Егер " 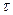 " уақыттан кейінгі Ажәне В заттарының концентрациясын (а-х) жене (b-х) десек, оңда (4) теңдеуді былай жазады:
" уақыттан кейінгі Ажәне В заттарының концентрациясын (а-х) жене (b-х) десек, оңда (4) теңдеуді былай жазады:
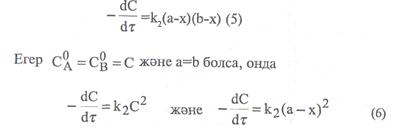
Егерде (5) және (6) теңдеулерді интегралдап, екінші ретті реакциялардың кинетикалық теңдеуін төменгі түрге келтіреміз:

Екінші ретті реакцияның жартылай өту уақыты заттардың бастапқы концентрациясына кері пропорционал екенін көреміз.
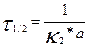 (9)
(9)
Тапсырма N 1.
2. РЕАКЦИЯ ЖЫЛДАМДЬІҒЫНА КАТАЛИЗАТОРДЫҢ ӘСЕРІ
Сu+2 және Ғе2+ иондарының HJ+(NН4)2S2О8 реакциясы жылдамдығына әсері.
Иодсугек қышқылы аммоний персульфатымен тотыққанда жүретін реакция:
2HJ+(NН4)2S2О8=2NН4НS04+J2.
Катализаторсызөтубаяужүреді. Реакцияжылдамдығынкесімдіуақытбірлігіңдебөлінгениодтыңмөлшеріменанықгайды. Егериодсутекқышқылының (HJ) аммонийперсульфатыментотығуреакциясынСu+2жәнеҒе+2иондарықатысындажүргізетінболсақ, ондареакцияедәуіржылдамжүреді. Реакциянәтижесіндебөлінетін J2мөлшерінкрахмалқатысынданатрийбиосульфаты (Nа2S2О3) ерітіндісіментитрлепанықгайды. Титрлеукезіндежүретінреакциятендеуі:
J2+2Nа2S2О8 = 2NaJ+Na2S4О6
Реакция аяқталғанда ерітіндінің көк түсі жойылады, себебі ерітіндіде крахмалмен әрекетгесіп көк түсті комплекс қосылыс беретін бос иодтың молекулалары қалмайды. НJ+(NН4)2S2О8 мен мыс тұздарының (СuSО4*5Н2О) немесе темір тұздарының (ҒеSО4*7Н2О) қатысында тотығу реакциясы гомогенді-катализдік реакция. Бұнда әрекеттесуші заттар да, катализатор да бірдей агрегаттық күйде, яғни сұйық күйде алынған.
Жұмыстың мақсаты:
1. Реакция жылдамдығына катлализатордың әсерін зерттеу.
2. Реакция жылдамдығын Сu+2 және Ғе2+ иондарының жеке-
жеке әсерін және олардың қоспаларының әсерін анықгау.
3. Алынған мәліметтер бойынша жеке катализатордың және
олардың қоспасының әсері жөнінде қорытынды жасау.
Жұмысқа қажетті заттар:
0,01 М - (NН4)2S2О8; 0,0005М СuSО4*5Н2О;
0.1М-КJ; 0,0005М Ғе SО4*7Н2О;
0,025М-Н2SО4; 0,01М Nа2S2О3.
Крахмал ерітіндісі, колбалар, пипетка, бюретка, воронка,
секундомер.
І-тәжірибе. Жұмыстың барысы:
Көлемдері 300 мл 6колбаға алу керек.
N 1 колбаға – 250 мл дистил Н2О,
N 2 колбаға — 250 мл (NН4)2S2О8 ерітіндісін,
N 3 колбаға — 250 мл KJ ерітіндісін,
N 4 колбаға – 250 мл Н2SО4 ерітіндісін,
N 5 колбаға – 250 мл 0,0005 М СuSО4 * 5Н2 О ерітіндісін,
N 6 колбаға - 250 мл 0,0005М ҒеSО4 * 7Н2О ерітіндісін құйып, барлық колбалардан ертінділерді бірдей температурада (термостатта) ұстайды. Алты колбаның әрқайсысына 10 мл дистил.су құйып, мұзды суда салқындатып қояды.
Колбалардағы ерітінділердің температуралары тұрақгалған соң, таза жуылған көлемі 300 мл колбаға ретін аустырмай пипеткамен
+100 мл — дистил Н2О,
+50 мл - (NН4)2S208,
+50 мл - НҢщЗОҢ,
+50 мл — KH ерітіндісін құяды.
KJ ерітіндісін қосқан уақытта (реакцияның басталған уақьггы деп санайды секундомерді іске қосу керек).
Колбадағы қоспаны араластырыш, реакция басталған уақыттан бастап 5,10,20,30,50,60 мин. өткен сайын пипеткамен 20 мл қоспаны алдын ала салқындатылған 100 мл су бар колбаға құйып, 3-5 тамшы крахмал ерітіндісін қосып, бюреткадағы персульфат ерітіндісімен ерітіндінің көк түсі жойылғанша титрлейді. Көк түс жойылуы реакцияның аяқталғандығын көрсетеді. Бюреткадан титрлеуге жұмсалған биосульфат ерітіндісі көлемдерін жазып алады.
2-тәжірибе.
Таза жуылған көлемі 300 мл колбаға +50 мл дистилденген су,
+50 мл мыс купоросы, +50 мл Н2SО4, +50мл(NН4)2S208, +50 мл КJ ерітінділерін
қосады. Ерітіндісін қосқан уақытта секундомерді белгілеп, I-тәжірибедегідей 3,5,10,20,40,60 мин. өткен сайын қоспадан алынған 20 мл ерітіндіні ішінде алдын ала салқындатылған 10 мл суы бар колбаға құйып, крахмал қатысында Nа2S2О8 ерітіңдісімен титрлейді.
Титрлеуге кеткен ерітіндінің көлемдерін жазып алады.
3 -тәжірибе.
Жұмыс, 2-тәжірибедегідей орындалады. Тек қана мыс купоросы (СuSО4-5Н2О) орнына темір купоросы (ҒеSО4 * 7Н2О) ерітіндісінен 50 мл алады.
Реактивтерді қосу реті, титрлеу жұмысы өзгермейді. Титрлеуге жұмсалған ерітіндінің көлемдерін жазып алады.
4-тәжірибе.
300 мл колбаға 50 мл-(СuSО4 * 5Н2О + ҒеSО4 * 7Н2О),
50 мл - (NН4)2S208,
50 мл - Н2SО4,
50 мл-KJ ерітінділерін құяды.
KJ – ты қосқан кезде уақытты белгілеп, қоспаны тез араластырады да 1,2.8, 5, 15, 30 мин. өткен сайын 20 мл ерітіндіні алып, колбадағы 100 мл салқындатылған суға қосып, крахмал қатысында Nа2S2О3 мен титрлейді. Титрлеуге жұмсалған ерітіндіні көлемдерін жазып алады. Алынған мәліметтер бойныша (кесте) абсцисса өсі бойымен уақыт (т, мин) ал, ординат өсі бойымен титрлеуге жұмсалған Nа2S2О3 көлемін (І), мл) алып, график сызып, оларды өзара салыстырып химиялық реакция жылдамдығына катализатор әсері жөнінде қорытынды жасау керек.
№5 лекция. Катализатордың тасымалдаушысы.
Ерітінділерде жүретін көптеген реакцияларда катализатор рөлін қышқылдар мен негіздер атқарады. (гидролиз, алкилдеу, этерификация т.б.) қышқыл-негізді катализ үшке бөлінеді:
І.Спецификалыққышқылдық (негіздік) катализ, катализатор рөлін Н3О+ не ОН- иондары атқарады.
2.Жалпы қышқылдық (негіздік) катализ, бұл катализді кез-келген донор (акцептор) протоны іске асырады.
З.Электрофильді (нуклеофильді) катализ, Льюс қышқылдары мен негіздері арқылы жүзеге асады.
Спецификалық қышқьш-негізді катализ үшін, процестің жалпы жылдамдығы Н3О+, ОН- иондарымен катализденетін реакциялардың жылдамдықтарының қосындысына тең.
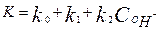 (9)
(9)
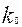 - каталитикалық емес реакцияның жылдамдық тұрақтысы,
- каталитикалық емес реакцияның жылдамдық тұрақтысы,
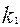 ,
, 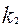 - концентрациялары бірге тең катализаторды реакдияның
- концентрациялары бірге тең катализаторды реакдияның
жылдамдық тұрақтылары.
Егер каталитикалық емес реакциялардың жылдамдығы аз болса,
Онда 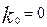 (9)-теңдеуділогарифмдесек, онда
(9)-теңдеуділогарифмдесек, онда
Lgk = lgk1-РН (қышқыл ерітінділер үшін) (10)
Lg = lgk2k 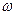 + РН (сілті ерітінділер үшін) (11)
+ РН (сілті ерітінділер үшін) (11)
Мұндағы -судың ионды көбейтіндісі.
(10), (11) теңцеулердің анализі бойьшша, спецификалыққышқыл-негізді катализдеуде. 1gК реакция жылдамдығы ортаның рН-на сызықгық теуеддікте болады.
Каталитикалық әсерлесудің Н3О+ механизмі мынада, катализатор (Н3О+) молекуласынан бастапқы заттарға ашнның өтуі есебінен аралық қосылыс тұзіледі. Осы процесс есебінен бастапқы затгарда болған химиялық байланыс өлсірейді, активтілік энергиясы төмендейді, онан ары ВН+ реакция өнімі мен катализаторға мына схема бойынша ыдырайды:
В+Н30+ 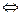 ВН++Н20
ВН++Н20
ВН++Н2О 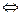 D+Н30+
D+Н30+
Жұмыстың орындалуы
Өлшеуіш колбаға (көлемі 250 см3) 25см3, 0,1 Н J2 ерітіндісі 4% KJ оған 25 см3; 1,0 м НСІ ерітіндісін белгіге 20 см3 қалғанша Н2О дистилденген суды қосады, оған термостатты ендіреді.
Аналитикалықтаразыда ішіне 10-15 см3 Н2О құйылған, пробкасы сүртілген конус тәрізді колбаның салмағын өлшейді. Градуирленген пипетканың көмегімен 1,5 г ацетонды (р=0,7298 г/см3) өлшеп колбаға салады да аналитикалықтаразыда өлшеп, колбаның салмағын алынған ацетон массасының айырмашылығымен анықтайды.
Сулы ацетон ерітіндісі бар колбаны термостатқа орналастырып, 10-15 мин ұстап, ерітінді өлшеуіш колбаға құяды, дистилденген Н2О судың 1 не 2 бөлігімен ерітіндіні шаяды да оны да өлшеуіш колбаға белгіге келгенше кұяды. Бұл реакцияның бастапқы кезі деп есептеледі.
Анализге пробаларды реакция басталғаннан кейін алады да, бір сағат өткеннен кейін оларды әр 30 мин. сайын 3-4 рет алады.
Алынған пробаларды (25 см3-тен) 0.1 Н, 25 см3NaНСО3 ерітіндісіне құйып, оны 0,01 Н Na2S2О3 ерітіндісімен (крахмал қатысында) титрлейді. Осыжерден х=(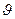 0-
0- 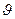 )* С *10-3 есептейді.
)* С *10-3 есептейді.
Мұндағы 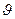 0,
0, 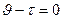 ,
, 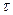 >10°С кезіндегі титрлеуге кеткен гипосульфит ерітіндісі, С — Nа2S2О3-ерітіндінің концентрациясы
>10°С кезіндегі титрлеуге кеткен гипосульфит ерітіндісі, С — Nа2S2О3-ерітіндінің концентрациясы
Nа2S2О3, г.экв/л.
Реакцияны t>25°С температурада жүргізеді. Өте төмен температурада баяужүреді.
Тапсырма.
1. Реакцияның жыддамдық константасын анықта 50,90,99%
ацетонды иодтау уақытын есепте.
2. Екі температурада реакция жылдамдығының константасын
анықта. Активтілік энергиясын есепте.
3. Cацет = f(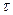 ) графигін тұрғызу.
) графигін тұрғызу.
6.НӘТИЖЕЛЕР МЕН ЕСЕПТЕУЛЕРДІ ТЕОРИЯЛЫҚ ТҮСІНДІРУ
Қышқыл орта
Сутегі иондарының қатысында (гидроксоний Н3О+) ацетон
протофильді болады:
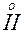
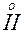
СН3-С-СН3+Н3О = [СН3-С-СН3] + Н20.
Кетоенол катионның метил тобының сутегісі қозғалғыш келіп, ол су молекуласымен қосылады
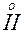
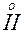
[СН3-С-СН3]++Н20 = СН3-С=СН2+Н3О+
Бұл реакция баяу жүреді. Реакцияның бірінші сатысы таутамер түзілуінде кетон, енол түзіледі. Екінші сатысында енол иодты жалғайды.
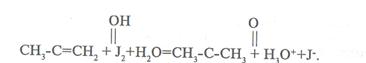
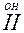
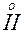
CH3- C = CH2 + J2 + H2 O = CH3 – C – CH3 + H2 O+ +J-
Бұл сатысы өте тез 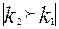 .
.
ҚышқылортадареакциябарысындагидроксонийиондарыныңН3О+ұлғаюыреакциянытездетеді.
Мұндай өздігінен тез жүретін реакциялар автокаталитикалық деп аталады. Берілген реакцияның жылдамдығы ацетон мен сутегі ионының концентрациясына тәуедді болғандықтан, бұл реакция II-ші ретпен жүреді.
Егер ацетон концентрациясын СА, гидроксоний ионының концентрациясын Св десек, " 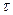 " уақыт кезіндегі реакцияға "х" моль ацетон түсіп "х" моль-эквивалент Н3О+, сонша эквиваленг J- түзіледі.
" уақыт кезіндегі реакцияға "х" моль ацетон түсіп "х" моль-эквивалент Н3О+, сонша эквиваленг J- түзіледі.
Реакция жылдамдығының константасы мына теңдеумен есептелінеді:
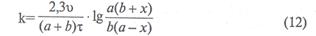
мұнда "а"-ацетонның моль саны, "b"-гидроксоний ионының саны
CA= (a – x) 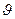 ;CB= (b + x)
;CB= (b + x) 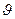 (13)
(13)
мұнда " 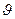 -ерітіндінің жалпы көлемі (250 см3), "х"-моль сандары.
-ерітіндінің жалпы көлемі (250 см3), "х"-моль сандары.
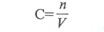
(СН3)3СО мөлшерін салмақпен, концентрациясы берілген қышқыл ерітіндісінен Н+ иондарын, кеткен ацетон мөлшерін-иодтық шынымен, иодталуға кеткен. Сонда есептеуде 1 ғана айнымалы шама қалады, оны реакциялыққоспаны гипосульфит ерітіндісімен титрлеп есептейді.
Есептеу барысы (СН3)2СО салмағы
Температура...°С моль сандары
Концентрация, г/экв/л (СН3)2СО (25 см3)
НСІ ерітіндісі үшін "а" эквивалент саны
J2 ерітіндісі үшін H+ (25 см3)
Колба массасы, г... араласу кезі...
№6 лекция. Катализатордың химиясы.
Катализатор мен әрекеттесуші заттар ортақ бір фаза құрайтын болса, мұны гомогенді катализ деп атайды. Гомогенді катализдің теориясының басты жағдайы былайша: реакция барысында катализатор мен әрекеттесуші заттардың тұрақсыз аралық өнімдері түзіліп, олар катализатордың регенерациясы арқылы ыдырап кетеді. Мұны схема бойынша көрсетеміз
А+В+К<=>(А-В-К)->Д+К.
Реакция жылдамдығы 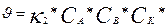
Жылдамдықконстантасы мына тендеумен өрнектеледі:

Мұндайда екі жағдай кездеседі:
1-ші жағдай: комплекстің катализатор мен бастапқы заттарға ыдырау жылдамдығы, соңғы енім түзілетін 2-ші стадия 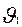 жылдамдығынан өте үлкен. Сондықтан Аррениус комплекстерінің концентрациясы аз болады.
жылдамдығынан өте үлкен. Сондықтан Аррениус комплекстерінің концентрациясы аз болады.
2-ші жағдай: егер аралық өнім АК бастапқы заттар мен тепе-теңцікте тұрса, онда тіке реакция жылдамдығы кері 2 реакция жылдамдығы тең болуы керек.
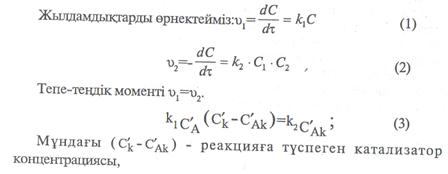
|
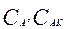 - аралық қосылыстың тепе – теңдік концентрациялары, А.
- аралық қосылыстың тепе – теңдік концентрациялары, А.
(3) теңдеуден аралық қосылыстардың концентрациясын табамыз:
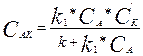
 (4)
(4)
Процестің жылдамдығы (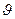 ), ең баяу стадиядағы жылдамдықпен анықталады:
), ең баяу стадиядағы жылдамдықпен анықталады:
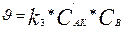 (5)
(5)
(4) пен (5)-ті қойсақ, онда 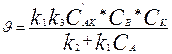 (6)
(6)
(6) тендеу екі шекті жағдайдың бар болуына бағыт береді:
1. егер 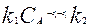 , онда
, онда 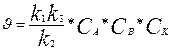 (7)
(7)
2. егер 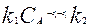 , онда
, онда 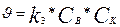 (8)
(8)
Екі жағдайда да реакция жылдамдығы катализатор концентрациясына пропорционал.
Реакцияның рет бастапқы заггары бойынша әр түрлі, ол 2 не 1-ге тең. Берілген шекті жағдайларда реакция реті бөлшекті (1<п<2).
Термиялық ьщырау, мысалы: СН3СООН J2 СН4+СО.
І2-катализдің буы.
Бу жоқ болғанда: J2 Eak  =191,9 кДж/моль;
=191,9 кДж/моль;
Бу бар болғанда:J2 Еak = 136,9 кДж/моль.
Жылдамдық константасы 104 өседі. Ол 2-стадияда жүреді.
1-стадиясы. СН3СООН+J2=СН3J+HJ+СО.
2-стадиясы. СН3J+HJ=СН4+J2.
Әр стадияның активтілік энергиясы каталитикалық емес реакциялардың активтілік энергиясынан кем.
Гомогенді катализге көптеген қышқыл-негізді әректтесу реакциялары, комплекс түзуші реакциялар, тотығу-тотықсыздану реакциялары, гидрлеу, сульфирлеу, т.б. реакциялар.
№7 лекция. Гетерогенді катализаторладың теориясы мен механизмдері
Көптеген гетерогенді процестердің (гетерогенді катализдік реапкциялар, қатты заттардың сұйық еріткіштерде еруі т.б.) саты-ларының бірі адсорбция сатысы болып табылады. Реакция жүйесін-дегі заттар қатты дененің бетіне адсорбцияланады. Процестің кине-тикасы адсорбция сатысымен анықталынатын болса, реакцияның жылдамдығы Ленгмюрдің адсорбция теориясымен сипатталады (адсорбция моноқабатты болған жағдайда). Мысалы, мономоле-кулалы гетерогенді катализдік А В реакциясының жылдамдығы
V=kөАКӨПТЕГЕН ГЕТЕРОГЕНДІ ПРОЦЕСТЕРДІҢ ()
(97)
Ленгмюр теориясы бойынша
ө = 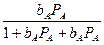 осыдан V =
осыдан V = 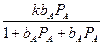 (98)
(98)
Мұндағы:
k – пропорционалдық коэфициент;
ө – қатты дене бетінің адсорбцияланған бөлігі (үлес);
bА және bВ – А және В заттарының адсорбциялық коэфициенті;
Ра және РВ – осы заттардың концентрациялары (парциал қысымы).
Гетерогенді катализдік процестер кинетикалық аймақта өтетін жағдайда реакция жылдамдығының теңдеулері мынадай дифферциал-ды теңдеуді шешу арқылы табылады:
V= 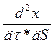 = 1(kS, bі, Рі), (99)
= 1(kS, bі, Рі), (99)
Мұндағы:
V – реакция жылдамдығы, ол д τ уақытта катализатордың
д S бетінде реакцияға түскен зат мөлшерімен (х) өлшенеді;
kS – катализатор бетінде өтетін реакцияның жылдамдық
константасы;
bі – реакциясалатын заттардың адсорбцияолық коэфициенті;
Рі – осы заттардың реакция аймағының әртүрлі бөліктеріндегі
парциал қысымы.
Газ ағынында өтетін бірінші ретті гетерогенді катализдік реакциялардың жылдамдығы (99) – теңдеу негізінде алынған Фрост теңдеуімен анықталады:
V∙1n 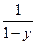 = α + βVу (100)
= α + βVу (100)
Мұндағы:
V – реакцияласатын газдың уақыт бірлігінде ағынынан
катализаторкөлемінің бірлігіне келу жылдамдығы;
у – түрлену дәрежесі (степень превращения);
α – катализатордың толық бетіне және сонда өтетін химиялық реакцияның жылдамдық константасына тура пропорционал тұрақты шама;
β – заттың (газдың) адсорбциялдық коэфициентін
сипаттайтын тұрақты шама.
Фрост теңдеуіндегі α және β коэфициенттері реакцияның кинетикасын сипаттайды. Олардың мәндерін табу үшін V∙1n 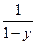 ~Vу тәуелділігі бойынша график тұрғызып, одан алынғарн түзудің абсцисс (Vу) осімен жасайтын бұршының тангенсін (β)және ординат осінің түзуімен қиылысқан нүктесіне дейінгі аралығын (α) анық-тайды.
~Vу тәуелділігі бойынша график тұрғызып, одан алынғарн түзудің абсцисс (Vу) осімен жасайтын бұршының тангенсін (β)және ординат осінің түзуімен қиылысқан нүктесіне дейінгі аралығын (α) анық-тайды.
М Ы С А Л Е С Е П Т Е Р
1-мысал. Белок молекуласының радиусы қандай? Ерітіндідегі диффузиялық коэфициент D=6,39∙10-7см2/сек, Т=2980К. Белок моле-куласының формасын сфералық форма деп есептеу керек:
η=1,227∙10-3 Па∙сек.
Шешуі: Стокс-Эйнштейннің теңдеуін қолданамыз:
r = 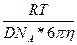 =
= 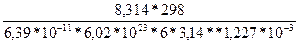 = 2,79∙10-9м.
= 2,79∙10-9м.
2-мысал. Бензой қышқылының беттік қабатының ауданы S=2см2 таблеткасы бензой қышқылы ерітіндісіне салынды. Ерітінді көлемі 20л, концентрациясы 0,003моль/л. Ерітіндіні араластыру нәтижесінде 5минут ішінде қышқылдың 0,001мольі еріді. Бірақ ері-тіндінің концентрациясы бұрынғысынан өзгермеді деп есептеуге болады. Қышқылдың қаныққан ерітіндісінің концентрациясы СS=0,024моль/л (2980К). Бензой қышқылының диффузиялану коэф-фициенті D=0,75см2/тәулік. Еру жылдамдығының константасын k, диффузия жылдамдығын β және беттік қабаттың қалындығын σ анықтаңыздар.
|
|
Дата добавления: 2014-12-10; Просмотров: 1776; Нарушение авторских прав?; Мы поможем в написании вашей работы!