
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Біохімія м’язів і м’язового скорочення
|
|
|
|
М’язи завдяки функції скорочення забезпечують процеси руху. При скороченні м’язів використовується хімічна енергія АТФ, яку вони перетворюють у кінетичну (механічну) енергію. Рухливі якості людини, особливо сила та швидкість, залежить від морфологічної будови м’язів, особливостей перебігу в них біохімічних процесів. Тому для розуміння біохімічних процесів, що забезпечують функцію скорочення м’язів, необхідно розглянути структурну організацію та хімічний склад м’язових волокон, при цьому особливо цікаве функціонування скелетних м’язів.
М’язи складаються з клітин довжиною до 10 см і близько 0,1 мм у діаметрі. Через велику довжину їх часто називають волокнами. Кожний структурний компонент волокна виконує свою певну функцію.
Оболонка м’язової клітини – сарколема. Вона являє собою двошарову ліпопротеїдну мембрану, бере участь у розслабленні м’язів, повертаючи їх у вихідне положення. Крім того, сарколема має здатність вибіркової проникності для різних речовин. Через неї не проходять високомолекулярні сполуки: білки, вищі жирні кислоти, але проходять глюкоза, молочна та піровиноградна кислоти, амінокислоти, кетонові тіла. При зміні реакції середовища в бік кислої, збільшується проникність сарколеми й для високомолекулярних речовин. Вибіркова проникність сарколеми має дуже важливу роль у виникненні збудження. Сарколема легко проникна для іонів К+. Тому їх завжди більше всередині клітини, ніж у міжклітинній рідині. Спеціальний Na+-насос видаляє іони Na+ із клітини, тому їх концентрація більша поза клітиною, ніж концентрація іонів К+ усередині клітини. Крім того, усередині волокна міститься велика кількість органічних аніонів. Все це призводить до поляризації сарколеми. Зовнішня поверхня її заряджена позитивно, а внутрішня – негативно. – це мембранний потенціал м’язової клітини.
|
|
|
Внутрішній простір м’язового волокна – саркоплазма. У ній містяться різні субклітинні частинки: ядра, мітохондрії, рибосоми, міофібрили та ін. Саркоплазма являє собою білковий колоїд, в який вкраплені різні включення. Близько 70-80 % маси м’яза становить вода. Значну частину сухого залишку (17-20 % маси м’яза) складають білки, іншу – азотисті і безазотисті органічні речовини, мінеральні солі, вільна фосфатна кислота.
М’язові білки розподілені таким чином: 40 % знаходиться в міофібрилах, 30 % – у саркоплазмі, 14 % – у мітохондріях, близько 15 % у сарколемі, незначна частина в ядрах і інших клітинних органелах.
У мітохондріях зосереджені структурні білки, а також білки-ферменти циклу трикарбонових кислот. Нерозчинний залишок білків складає м’язову строму. В основному це колаген і еластин сарколеми і міостромін, який зв’язаний із двома пластинами міофібрил. М’язова строма має високу еластичність і бере участь у розслабленні м’язів. З водорозчинних азотистих сполук найбільш важливими для роботи м’язів є АТФ і креатинфосфат. Це – енергетичні джерела м’язового скорочення. Продукти їх розпаду – АДФ, АМФ, креатин – здійснюють регулюючу дію на обмін речовин у м’язах. З інших азотистих сполук є амінокислоти (переважно глутамінова кислота), пуринові основи, аміак, сечовина.
До найважливіших безазотистих сполук м’язів належать глікоген і продукти його обміну, жири, холестерин, кетонові тіла, мінеральні солі. Глікоген знаходиться як у вільному, так і зв’язаному з білками стані. Залежно від харчового раціону і ступеня тренованості м’язів кількість його коливається від 0,2 до 3 %. За умов тренування збільшується переважно кількість вільного глікогену.
З мінеральних речовин у м’язах є іони К+, Na+, Mg2+, Сa2+, Cl–, H2PO4–, HPO42– (1-1,5 % маси м’язів). Мінеральні іони виконують важливу роль у регуляції біохімічних процесів при скороченні м’язів.
|
|
|
Головна відмінність м’язових волокон від інших клітин організму полягає в тому, що в саркоплазмі їх знаходиться до тисячі і більше забраних у пучки довгих ниток – міофібрил, їх довжина може досягати довжини м’язового волокна. У нетренованих м’язах міофібрили розсіяні по всій клітині, а в тренованих – зібрані в пучки. Кожна міофібрила складається з товстих і тонких ниток – протофібрил, які як і вся міофібрила, мають поперечно-смугастий вигляд (рис. 10).
Товсті нитки – це білок міозин, який складається з двох ідентичних найбільш довгих із відомих на цей час ланцюгів. Кожний ланцюг молекули міозину закручений у вигляді α-спіралі, причому обидва ланцюги утворюють суперспіраль, тобто закручені один навколо одного, створюючи двоспіральну структуру. На одному кінці молекули міозину обидва ланцюги утворюють глобулярну структуру (рис. 11).
Молекула міозину містить значну кількість глутамінової кислоти і тому має досить значний негативний заряд. Поперечні містки товстих ниток – це глобулярні голівки білку міозину.
Тонкі протофібрили – це білок актин. Існує три форми актину: мономерний (глобулярний) (G), димерний (глобулярний) і полімерний (фібрилярний) (F). Фібрилярний актин є продуктом полімеризації глобулярного актину. Окремі ланцюги, утворені глобулярною формою актину, утворюють подвійну спіраль, або суперспіраль.
|
|
|
|
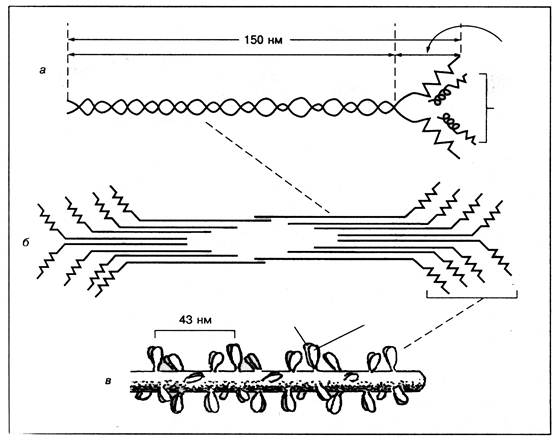
Рис. 10.
Схема будови молекули міозину (а),
міозинового пучка (б) і міозинової товстої нитки (в)
З димерів побудована подвійна спіраль полімерного фібрилярного актину.
У міофібрилах міститься також тропоміозин – білок, що утворює комплекс з білком тропоніном – глобулярним білком. (Будова міофібрил, рис.)
|
|

Рис. 11.
Схема молекули міозину (а), та подвійної спіралі F-актину (б).
Тропонін має значний негативний заряд. У розслабленому м’язі тропоміозин блокує нитки актину, а тропонін інгібує ферментативну активність міозину, запобігаючи розщепленню АТФ і звільненню енергії, необхідної для м’язового скорочення. Блокада знімається іонами Са2+, які зв’язуються з комплексом тропонін-тропоміозин і інактивують його.
|
|
|
Між фібрилами розміщуються мітохондрії – “енергетичні станції” м’язових волокон. Кількість мітохондрій у тренованих м’язах порівняно з нетренованими збільшується.
Кожну міофібрілу оточує система подовжніх і поперечних трубочок, пухирців, мембран, яка називається саркоплазматичною мережею або саркоплазматичним ретикулом. Він являє собою великі емності-цистерни. У них зберігаються іони Са2+. Через систему трубочок відбувається обмін речовинами між клітинними органелами і міжклітинною рідиною. Через трубочки поширюється хвиля збудження від сарколеми волокна до внутрішніх її зон.
Скорочення м’язів – це зближення ниток актину і міозину. За соті долі секунди спрацьовує довгий ланцюг хімічних і фізико-хімічних процесів. Це відбувається за командою-імпульсом. Центральна нервова система посилає у м’язи електричні імпульси, що рухаються по нервах зі швидкістю 70-120 м/с. Проте до м’яза ці сигнали не доходять, тому що між нервовим закінченням і м’язовою клітиною немає контакту. Вони розділені так званою синаптичною щілиною, яка створює величезний опір електричному імпульсу. Щоб м’яз одержав команду, електричний сигнал має бути перетворений у хімічну форму. Перетворювачем електричного сигналу служить синапс.
Він складається з двох мембран – на закінченнях нерва (пресинаптична мембрана) і м’язового волокна (постсинаптична мембрана). Між ними – синаптична щілина. У пресинаптичній мембрані заховані сотні тисяч пухирців з ацетилхоліном, який служить медіатором – хімічним передавачем сигналу. Під дією електричного імпульсу частина їх потрапляє в синаптичну щілину і досягає постсинаптичної мембрани. Цей медіатор і передає сигнал м’язовому волокну.Діючи на постсинаптичну мембрану (сарколему), ацетилхолін викликає її деполяризацію, з якої і починається ланцюг подій, що приводить до скорочення мязового волокна (рис. 12). Деполяризація підвищує проникність клітинних мембран, мембран внутрішньоклітинних каналів, цистерн, в яких концентрація іонів Са2+ у 10000 разів вища, ніж у саркоплазмі. Збільшення проникності призводить до того, що іони Са2+ «виливаються» із цистерн і концентрація їх у саркоплазмі зростає.
|
|
|
|
|
|
|
|

Рис. 12.
Скорочення м’язового волокна
Іони Са2+ зв’язуються з комплексом тропонін-тропоміозин і інактивують його. У результаті звільняються заблоковані реакційноздатні ділянки актину і голівки молекул міозину. Маючи АТФ-азну активність, голівки міозину розщеплюють молекули АТФ, які в них знаходяться. У результаті звільненої енергії глобулярні голівки згинаються, прикріплюються до актинових молекул. При цьому утворюються поперечні міозинові містки, які, як гумки, тягнуть на себе молекули актину. Актинові нитки сковзають уздовж міозину, втягуються в щілини між міозиновими молекулами. М’язове волокно скорочується (рис. 12).
У міру використання енергетичних запасів кожної молекули АТФ зв’язок міозину з актином розривається, а на голівці утворюється нова молекула АТФ, гідроліз якої знову “заряджає” поперечний місток енергією. Цей процес повторюється багаторазово, приводячи до все більш глибокого просування актинових ниток між міозиновими молекулами. Так відбувається перетворення хімічної енергії безпосередньо в механічну.
Доки в щілині є ацетилхолін, деполяризація м’язового волокна триває і воно не реагує на нові сигнали центральної нервової системи. Для нового скорочення необхідно зруйнувати медіатор. Робить це ацетилхолінестераза – фермент, який виділяє пресинаптична мембрана. За допомогою так званого кальцієвого насоса іони Са2+ закачуються в цистерни проти дифузного градієнту з витратою енергії АТФ. Зникнення іонів Са2+ із саркоплазми звільняє тропонін, який інгібує АТФ-азну активність міозину і відповідно утворення енергії. Актин і міозин повертаються на свої місця. М’яз розслаблюється. Всі ці складні хімічні реакції мають високу швидкість. Через деякі синапси за 1 секунду може проходити до 300 команд-імпульсів, тобто стільки разів виходить і руйнується ацетилхолін.
У відповідь на одиночний імпульс відбувається одиночне скорочення, яке супроводжується деполяризацією і реполяризацією м’язових волокон. Причому реполяризація відбувається до того, як м’яз повністю розслабиться. Якщо в цей момент надходить новий імпульс, скорочення ніби сумуються, саркомер (рухова одиниця) скорочується сильніше, ніж у випадку одиночного імпульсу.
Відповідно росте і сила, яку розвиває м’яз. При частоті імпульсів 20-35 с–1 відбувається скорочення, яке у 2-3 рази переважає за силою одиночне.
При подальшому збільшенні частоти імпульсів може настати такий стан, коли кожний новий сигнал буде припадати на майже повністю скорочений попереднім імпульсом м’яз. Тоді всі одиночні скорочення зливаються в одне. У цей момент м’язи розвивають найбільшу силу тяги, майже в 4 рази вищу, ніж при одиночному скороченні.
У тому випадку, коли частота нервових імпульсів значно вища, ніж потрібно, тоді через високу частоту виділення ацетилхоліну в синапсах і збільшення його концентрації холінестераза не встигає руйнувати його. М’язові волокна втрачають здатність сприймати нові імпульси, і сила рухових одиниць різко падає. Це спостерігається в стресових ситуаціях, у стані стомлення, при зусиллях, які перевищують фізіологічні можливості організму.
Поняття
|
|
|
|
Дата добавления: 2014-12-10; Просмотров: 3379; Нарушение авторских прав?; Мы поможем в написании вашей работы!