
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы электролитов. Катионы анионы
|
|
|
|
Изменение изобарно-изотермического потенциала (энергия Гиббса). Расчет энергии Гиббса для стандартных условий. Уравнение Гиббса. Анализ уравнения Гиббса.
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
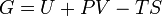
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста её энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
В химических процессах одновременно действуют два противоположных фактора — энтропийный (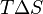 ) и энтальпийный (
) и энтальпийный (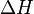 ). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (
). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (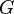 ):
):
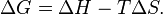
Из этого выражения следует, что 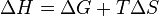 , то есть некоторое количество теплоты расходуется на увеличение энтропии (
, то есть некоторое количество теплоты расходуется на увеличение энтропии (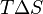 ), эта часть энергии потеряна для совершения полезной работы (рассеивается в окружающую среду в виде тепла), её часто называют связанной энергией. Другая часть теплоты (
), эта часть энергии потеряна для совершения полезной работы (рассеивается в окружающую среду в виде тепла), её часто называют связанной энергией. Другая часть теплоты ( ) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
|
|
|
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При 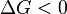 процесс может протекать, при
процесс может протекать, при 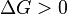 процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же
процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же 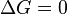 , то система находится в состоянии химического равновесия.
, то система находится в состоянии химического равновесия.
Обратите внимание, что речь идёт исключительно о принципиальной возможности протекания реакции. В реальных же условиях реакция может не начинаться и при соблюдении неравенства 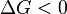 (по кинетическим причинам).
(по кинетическим причинам).
Существует полезное соотношение, связывающее изменение свободной энергии Гиббса  в ходе химической реакции с её константой равновесия
в ходе химической реакции с её константой равновесия 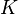 :
:
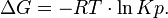
где Кр - равновесная константа по давлению (только в атмосферах),
Вообще говоря, любая реакция может быть рассмотрена как обратимая (даже если на практике она таковой не является). При этом константа равновесия определяется как
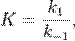
где  — константа скорости прямой реакции,
— константа скорости прямой реакции, 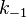 — константа скорости обратной реакции.
— константа скорости обратной реакции.
8. Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
Скорость химической реакции -Эта величина определяет, как изменяется концентрация компонентов реакции с течением времени.
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации с, температуры t, присутствия катализаторов, а также от некоторых других факторов (например, от давления - для газовых реакций, от измельчения - для твердых веществ, от радиоактивного облучения).
|
|
|
Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
Правило Вант-Гоффа гласит, что при повышении температуры на каждые 10о скорость химической реакции увеличивается в 2-4 раза.
Математически правило Вант-Гоффа выглядит так:

где V2 – скорость протекания реакции при температуре t2, а V1 – скорость протекания реакции при температуре t1;
ɣ - температурный коэффициент скорости реакции. Этот коэффициент есть отношение констант скоростей при температуре t+10 и t.
9. Химическое равновесие. Константа химического равновесия. Спообы нарушения химического равновесия. Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.[1]
А2 + В2 ⇄ 2AB
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс).
Положение химического равновесия зависит от следующих парамктров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1884 году французским ученым Ле-Шателье. Современная формулировка принципа Ле-Шателье такова:
Если на систему,находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия.
1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому.
N2 + 3H2s 2NH3 + Q
Прямая реакция - экзотермическая, а обратная реакция - эндотермическая. Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам:
|
|
|
При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении экзотермической реакции.
2. Влияние давления. Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переоходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам:
При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом;
при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом
10. Каталитические процессы. Энергетические диаграммы каталитических процессов. Катализатор.Механизм действия катализатора.
Каталитические процессы в настоящее время составляют основу химической технологии. Причем область их применения расширяется: около 90 \% новых производств, освоенных за последние годы химической промышленностью, основаны на взаимодействии, протекающем в присутствии катализаторов. Под катализом понимают изменение скорости химических реакций под воздействием веществ – катализаторов, которые, участвуя в процессе, остаются после его окончания химически неизменными. Катализ называется положительным, если катализатор ускоряет реакции, и отрицательным, если скорость реакции под воздействием катализатора снижается. Катализатор – в-во, которое увеличивает скорость хим. реакции, а сам в конце и начале реакции остается в неизменном состоянии. Применение катализаторов облегчает практическое осуществление многих химических реакций; скорость некоторых из них увеличивается в тысячи и даже миллионы раз. Очень многие промышленные процессы удалось осуществить только благодаря применению катализаторов. К числу каталитических процессов относятся важнейшие крупнотоннажные производства, например, такие как получение водорода, аммиака, серной и азотной кислот и многих других важнейших химических продуктов. Особенно велико и разнообразно применение катализа в технологии органических веществ и в производстве высокомолекулярных соединений. Отрицательный катализ применяется значительно реже: катализаторы замедляющие скорость процесса называют также ингибиторами. Катализаторами могут быть вещества, находящиеся в любом из трех агрегатных состояний. К твердым катализаторам можно отнести металлы и их оксиды, например, железо Fe при синтезе аммиака, платину Pt при окислении аммиака, оксид ванадия V2O5 при окислении SO2, Al2O3 при крекинге нефтепродуктов и др. Жидкими катализаторами служат обычно кислоты и основания, например, серная кислота H2SO4 и фосфорная кислота Н3РО4 применяются при алкилировании ароматических углеводородов, при изомеризации, н-бутилена в изобутилен и др.Примером газообразных катализаторов может служить BF3 в процессах полимеризации некоторых углеводородов. Каталитические процессы можно разделить на две группы: гомогенные и гетерогенные. В гомогенно-каталитических реакциях реагирующие вещества и катализатор составляют одну фазу, а в гетерогенно-каталити-ческих реакциях – разные фазы. В особую группу выделены микрогетерогенные и ферментативные каталитические процессы. Микрогетерогенный катализ происходит в жидкой фазе с участием коллоидных частиц металлов в качестве катализаторов. Катализатор может состоять из одного вещ-ва, а может представлять собой систему веществ, иногда довольно сложную. Действие катализатора в процессе изменения исходной химической системы часто бывает двояким – ускоряющим и ориентирующим. Продолжительность работы катализатора ограничена. Причиной тому являются вторичные реакции, которые приводят к изменению катализатора и потере им своей активности и своей селективности. В большенстве случаев катализатор за время своей жизни успевает переработать кол-во продуктов, во много раз превосходящую его собственный вес.
|
|
|

Механизм действия катализатора, как ускорителя химической реакции, основан на: 1) явлении адсорбции (поверхностное поглощение) катализатором реагирующих веществ, вследствие чего повышается их концентрация и 2) повышении химической активности адсорбированных молекул благодаря переходу их в возбужденное состояние, в результате чего резко возрастает доля успешных столкновений молекул реагирующих веществ и, соответственно, скорость химической реакции. Механизм действия катализаторов на кинетику химического процесса в настоящее время не может считаться окончательно выясненным. Проблема, связанная с раскрытием явлений, лежащих в основе каталитических процессов, оказалась очень сложной, и потребовалось много лет работы ряда ученых для того, чтобы более глубоко понять явление катализа.
11. Понятие о дисперсных системах и дисперсности. Классификация дисперсных систем.
Дисперсная система – это система, в которой одно вещество распределено в среде другого, причем между частицами и дисперсионной средой есть граница раздела фаз. Дисперсные системы состоят из дисперсной фазы и дисперсионной среды. Дисперсная фаза - это частицы, распределенные в среде. Ее признаки: дисперсность и прерывистость. Дисперсионная среда - материальная среда, в которой находится дисперсная фаза. Ее признак – непрерывность. Дисперсность - физическая величина, характеризующая размер взвешенных частиц в дисперсных системах.
Классификация дисперсных систем.
| Дисперсионная среда | Дисперсионная фаза | Условное обозначение | Название системы и примеры |
| Твердая | Твердая | Т/Т | тв. гетерогенные системы: сплавы, бетон |
| Твердая | Жидкая | Ж/Т | Капиллярные системы: жидкость в пористых телах, почвы, грунты |
| Твердая | Газообразная | Г/Т | Пористые тела: адсорбенты и катализаторы в газах |
| Жидкая | Твердая | Т/Ж | Суспензии и золи: извести, пасты, илы |
| Жидкая | Жидкая | Ж/Ж | Эмульсии: нефть, кремы, молоко |
| Жидкая | Газообразная | Г/Ж | Газовые эмульсии и пены: флотационные, противопожарные, мыльные пены |
| Газообразная | Твердая | Т/Г | Аэрозоли: дымы, порошки |
| Газообразная | Жидкая | Ж/Г | Аэрозоли: туманы, облака |
| Газообразная | Газообразная | Г/Г | Не образуется |
12. Классификация растворов. Способы выражения концентрации растворов (массовая доля, молярная, моляльная, эквивалентная концентрация, моляльная доля). Закон эквивалентов для растворов.
Классификация растворов: твердые (драг. камни), жидкие (ртуть + серебро), газооброзные.
Способы выражения концентрации растворов: 1. Массовая доля раств-го вещ-ва (%-я С) 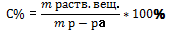 ; 2.Молярная концентрация (С M):
; 2.Молярная концентрация (С M):  ;
;  ; 3.Эквивалентная концентрация (нормальная С):
; 3.Эквивалентная концентрация (нормальная С): 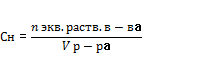 ;
; 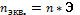 ;
;  ; 4.Моляльная Сm:
; 4.Моляльная Сm: 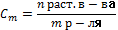 ;
; 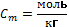 ; Закон эквивалентов для растворов:
; Закон эквивалентов для растворов: 
13 Коллигативные свойства растворов. Понижение температуры замерзания. Повышение температуры кипения. Закон Рауля.
Коллигативные свойства – это свойства растворов, зависящие от числа частиц растворенного вещества. К коллигативным свойствам растворов относят:
1) понижение давления насыщенного пара растворителя над раствором,
2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей.
3) осмотическое давление.
Понижение температуры замерзания:; - кристаллическая константа (из справочника)
Повышение температуры кипения:;  - эгулиоскопическая константа (из справочника)
- эгулиоскопическая константа (из справочника)
Закон Рауля: 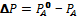 – называют обсалютным понижением давления насыщенного пара растворителя над раствором, а отношение его к давлению насыщенного пара растворителя над чистым растворителем
– называют обсалютным понижением давления насыщенного пара растворителя над раствором, а отношение его к давлению насыщенного пара растворителя над чистым растворителем  - относительным понижением. Из закона Рауля следует, что при некоторой температуре Т давление насыщенного пара растворителя
- относительным понижением. Из закона Рауля следует, что при некоторой температуре Т давление насыщенного пара растворителя  над чистым растворителем всегда больше, чем над раствором Р. Т.О. если растворить в воде какое-нибудь нелетучее вещество, то давление ее пара понизится. При этом разность
над чистым растворителем всегда больше, чем над раствором Р. Т.О. если растворить в воде какое-нибудь нелетучее вещество, то давление ее пара понизится. При этом разность 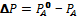 тем больше, чем выше концентрация растворенного вещества.
тем больше, чем выше концентрация растворенного вещества.
14. Произведение растворимости. Условия образования осадка.
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
CaCO3(s)⇌Ca2+(aq)+CO2−3(aq)
Константа этого равновесия рассчитывается по уравнению:
K ={Ca2+(aq)}{CO2−3(aq)}{CaCO3(s)}.
В приближении идеального раствора с учётом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
K sp=[Ca2+(aq)][CO2−3(aq)].Константа равновесия такого процесса называется произведением растворимости.
Осадок -выделение в виде твердого в-ва из газа (пара), раствора или расплава одного или нескольких компонентов. Для этого создают условия, когда система из исходного устойчивого состояния переходит в неустойчивое и в ней происходит образование твердой фазы. Осаждение из пара (десублимация) достигается понижением температуры (напр., при охлаждении паров иода возникают кристаллы иода) или химических превращений паров, к которому приводят нагревание, воздействие радиации и т.д. Так, при перегревании паров белого фосфора образуется осадок красного фосфора; при нагревании паров летучих  -дикетонатов металлов в присутствии О2 осаждаются пленки твердых оксидов металлов.
-дикетонатов металлов в присутствии О2 осаждаются пленки твердых оксидов металлов.
Осаждения твердой фазы из растворов можно добиться различными способами: понижением температуры насыщенного раствора, удалением растворителя выпариванием (часто в вакууме), изменением кислотности среды, состава растворителя, например добавлением к полярному растворителю (воде) менее полярного (ацетон или этанол). Последний процесс часто называют высаливанием. Широко применяют для осаждения различные химические реагенты-осадители, взаимодействующие с выделяемыми элементами с образованием малорастворимых соединений, которые выпадают в осадок. Например, при добавлении раствора ВаСl2 к раствору, содержащему серу в виде SO2-4, образуется осадок BaSO4. Для выделения осадков из расплавов последние обычно охлаждают.
Электроли́т — вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит врастворах и расплавах, или движения ионов в кристаллических решётках твёрдых электролитов. Примерами электролитов могут служить водные растворы кислот, солей и оснований и некоторые кристаллы (например, иодид серебра, диоксид циркония). Электролиты — проводники второго рода, вещества, электропроводность которых обусловлена подвижностью ионов.
Исходя из степени диссоциации все электролиты делятся на две группы
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3, H2SO4).
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относятводу, ряд кислот (слабые кислоты, такие как HF), основания p-, d-, и f- элементов.
Между этими двумя группами чёткой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого.
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы.
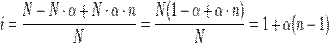 .
.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 646; Нарушение авторских прав?; Мы поможем в написании вашей работы!