
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Каковы особенности диссоциации солей
|
|
|
|
Каков механизм диссоциации солей в растворах или расплавах
Представьте, что будет с хорошо знакомой всем людям поваренной солью, если ее кристаллы расплавить или бросить в воду. Это вещество имеет структуру ионной кристаллической решетки. При расплавлении тепловая энергия приведет к тому, что колебания ионов в узлах решетки многократно усилятся, в результате чего связи между соседними ионами начнут разрушаться. Появятся свободные ионы. И этот процесс при продолжении нагрева будет продолжаться до полного разрушения кристаллической решетки. Аналогичный механизм разрушения будет и при растворении кристаллов поваренной соли в воде, только вместо тепловой энергии тут действуют молекулы воды, как бы «растягивающие» кристаллы на отдельные частицы.
Впервые теория электролитической диссоциации была выдвинута двумя химиками – Аррениусом и Оствальдом в конце XIX века. Именно с помощью диссоциации описывают свойства солей, а также оснований и кислот. Кислые и основные соли проходят диссоциации ступенчато, например, KHSO4 =K^+ + HSO4^-
При диссоциации солей образуются положительно заряженные катионы металлов (либо катион аммония), а также отрицательно заряженные катионы кислотных остатков. Процесс диссоциации идет в зависимости от того, какая соль подвергается растворению или расплавлению (средняя, кислая или основная).
Если соль средняя (то есть, образованная кислотой, в молекулах которой все катионы водорода замещены катионами металла, или аммония), диссоциация происходит по таким схемам, в одну стадию:
КNO3=K^++NO3^-
Na2SO4=2Na^++SO4^2-
Кислые и основные соли диссоциируют в несколько стадий. Кислая соль (то есть образованная кислотой, катионы водорода которой замещены не полностью) сначала теряет металлический ион, а затем отщепляется катион водорода. Например:
NaHSO4=Na^++HSO4^-
HSO4^-=H^++SO4^2-
У основных же солей (то есть образованных щелочами, у которых не полностью замещены гидроксил-группы), сначала отщепляются кислотные остатки, а потом ОН^- -ионы. Например:
Cu(OH)Cl = Cu(OH)^++Cl^-
Cu(OH)^+ = Cu^2++OH^-
|
|
|
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода. Например,
HNO3 «H+ + NO3–
Многоосновные кислоты диссоциируют ступенчато. Например сероводородная кислота диссоциирует ступенчато:
H2S «H+ + HS– (первая ступень)
HS– «H+ + S2– (вторая ступень)
Диссоциация многоосновных кислот протекает, главным образом, по первой ступени. Это объясняется тем, что энергия, которую нужно затратить для отрыва иона от нейтральной молекулы, минимальна и становится больше при диссоциации по каждой следующей ступени.
Основаниями называются электролиты, диссоциирующие в растворе, которые в качестве анионов образуют только гидроксид-ионы. Например,
NaOH ® Na+ + OH–
Многокислотные основания диссоциируют ступенчато
Mg(OH)2 «MgOH+ + OH– (первая ступень)
MgOH+ «Mg2+ + OH– (вторая ступень)
Ступенчатая диссоциация кислот и оснований объясняет образование кислых и основных солей.
Существуют электролиты, которые диссоциируют одновременно как основные и как кислотные. Они называются амфотерными.
H+ + RO– «ROH «R+ + OH–
Амфотерность объясняется малым различием прочности связей R–H и О–Н.
К амфотерным электролитам относятся вода, гидроксиды цинка, алюминия, хрома (III), олова (II, IV), свинца (II, IV) и др.
Диссоциацию амфотерного гидроксида, например Sn(OH)2, можно выразить уравнением:
2H+ + SnO22– «Sn(OH)2 «Sn2+ + 2OH–
+2H2O ¯ основные свойства
2H+ + [Sn(OH)4]2– кислотные свойства
Для многоосновных кислот и многокислотных оснований характерна ступенчатая диссоциация с отрывом одного нона Н+ или ОН по каждой ступени. Таким образом, число ступеней определяется основностью кислоты или кислотностью основания. Поскольку первый ион отрывается от нейтральной частицы, а последующие от частиц с зарядом противоположного знака, который увеличивается с каждой ступенью на единицу, то степень электролитической диссоциации сильно уменьшается при переходе от первой ступени к каждой следующей. Примером может быть фосфорная кислота при с=0,1 моль/л
|
|
|
17. Сильные электролиты. Активность ионов
Сильными электролитами называются такие электролиты, степень диссоциации которых в растворах равна единице (т.е. диссоциируют полностью) и не зависит от концентрации раствора. К ним относятся большинство солей, которые уже в кристаллическом состоянии построены из ионов, гидроксиды щелочных и щелочноземельных металлов, некоторые кислоты (НСl, HBr, HI, HClO 4, HNO 3).
В растворах сильных электролитов концентрация ионов довольно велика, так что силы межионного взаимодействия заметно проявляются даже при малой концентрации электролита. В результате ионы оказываются не вполне свободными в своем движении, и все свойства электролита, зависящие от числа ионов, проявляются слабее, чем следовало бы ожидать при полной диссоциации электролита на не взаимодействующие между собой ионы. Поэтому для описания состояния ионов в растворе пользуются, наряду с концентрацией ионов, их активностью,т.е. условной (эффективной) концентрацией ионов, в соответствии с которой они действуют в химических процессах. Активность иона а ( моль/л) связана с его молярной концентрацией в растворе С соотношением
a = fC
где f - коэффициент активностииона (безразмерная величина).
Коэффициенты активности ионов зависят от состава и концентрации раствора, от заряда и природы лона и от других условий. Однако в разбавленных растворах (С? 0,5 моль/л) природа иона слабо сказывается на величине его коэффициента активности. Приближенно можно считать, что в разбавленных растворах коэффициент активности иона в данном растворителе зависит только от заряда иона и ионной силыраствора I, которая равна полусумме произведений концентрации С каждого иона на квадрат его заряда z:
I =0,5 (С 1 z 12 + С 2 z 22 + …+ С n z n2) =0,5 С i z i2
|
|
|
В табл.1 приведены значения коэффициентов активности ионов в разбавленных растворах в зависимости от их заряда и ионной силы раствора. Приближенно коэффициент активности иона в разбавленном растворе можно также вычислить по формуле: lg f = - 0,5 z 2 -.
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
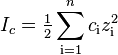 ,
,
где c i — молярные концентрации отдельных ионов (моль/л), z i - заряды ионов
18. Слабые электролиты. Константа и степень диссоциации
Молекулы слабых электролитов лишь частично диссоциированы на ионы, которые находятся в динамическом равновесии с недиссоциирующими молекулами. К слабым электролитам относятся многие органические кислоты и основания в водных и неводных растворителях. Степень диссоциации зависит от природы растворителя, концентрации раствора, температуры и других факторов (<1). Один и тот же электролит при одинаковой концентрации, но в различных растворителях образует растворы с различной степенью диссоциации. В растворах слабых электролитов устанавливается равновесие между недиссоциированными молекулами и продуктами их диссоциации - ионами. Например, в водном растворе уксусной кислоты устанавливается равновесие
СН з СООН Н + + СН 3 СОО -
константа которого (константа диссоциации) связана с концентрациями соответствующих частиц соотношением:
К = [н +] [ сн 3соо-]
[ сн 3 соо ]
Степенью диссоциации а электролита называется доля его молекул, подвергшихся диссоциации, т.е. отношение числа молекул, распавшихся в данном растворе на ионы, к общему числу молекул электролита в растворе.
В случае электролита MX, диссоциирующего на ионы М + и Х -, константа и степень диссоциации связаны соотношением (закон разбавления Оствальда)
К = а 2 С /1 - а
где С - молярная концентрация электролита, моль/л.
Если степень диссоциации значительно меньше единицы, то при приближенных вычислениях можно принять, что 1 - а 1. Тогда выражение закона разбавления упрощается:
|
|
|
К = а 2 С. Отсюда
Последнее соотношение показывает, что при разбавлении раствора (т.е. при уменьшении концентрации электролита С) степень диссоциации электролита возрастает.
Если в растворе электролита MX степень его диссоциации равна а, то концентрации ионов М + и Х - в растворе одинаковы и составляют:
[ М +] = [ Х -] = аС
Подставив сюда значение а из предыдущего соотношения, находим:
[ М +] = [ Х -] = С =
Для расчетов, связанных с диссоциацией кислот, часто удобно пользоваться не константой К, а так называемым показателем константыдиссоциации рК, который определяется соотношением
рК = - lg К
Очевидно, что с возрастанием К, т.е. с увеличением силы кислоты, значение рК уменьшается; следовательно, чем больше рК, тем слабее кислота. При введении в раствор слабого электролита одноименных ионов (т.е. ионов, одинаковых с одним из ионов, образующихся при диссоциации электролита) равновесие диссоциации нарушается и смещается в направлении образования недиссоциированных молекул, так что степень диссоциации электролита уменьшается. Так, прибавление к раствору уксусной кислоты ее соли (например, ацетата натрия) приведет к повышению концентрации ионов СН 3 СОО - и, в соответствии с принципом Ле Шателье, равновесие диссоциации
СН з СООН Н + + СН 3 СОО -
сместится влево.
В растворах многоосновных кислот, а также оснований, содержащих несколько гидроксильных групп, устанавливаются ступенчатые равновесия, отвечающие последовательным стадиям диссоциации. Так, диссоциация ортофосфорной кислоты протекает в три ступени, каждой из которых отвечает определенное значение ступенчатой константы диссоциации.
Н 3 РО 4 - Н + + Н 2 РО 4 - (К 1=7,5.10-3)
Н 2 РО 4 - - Н + + НРО 42 - (К 2=6,3.10-8)
НРО 42 - - Н + + РО 43 - (К 3=1,3.10-12)
Поскольку К 1 >> К 2 >> К 3,то в наибольшей степени протекает диссоциация по первой ступени, а при переходе к каждой последующей стадии степень диссоциации, как правило, резко уменьшается.
Диссоциация электролита приводит к тому, что общее число частиц растворенного вещества (молекул и ионов) в растворе возрастает по сравнению с раствором неэлектролита той же молярной концентрации. Поэтому свойства, зависящие от общего числа находящихся в растворе частиц растворенного вещества (коллигативные свойства), - такие, как осмотическое давление, понижение давления пара, повышение температуры кипения, понижение температуры замерзания - проявляются в растворах электролитов в большей степени, чем в равных по концентрации растворах неэлектролитов. Если в результате диссоциации общее число частиц в растворе электролита возросло в i раз по сравнению с числом его молекул, то это должно быть учтено при расчете осмотического давления и других коллигативных свойств
| Нейтральная среда | [H+] = [OH-] = 10-7 М |
| Кислая среда | [H+] > [OH-], [H+] > 10-7 М, [OH-] ˂ 10-7 М |
| Щелочная среда | [H+] ˂ [OH-], [H+] ˂ 10-7 М, [OH-] > 10-7 М |
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:

Здесь  — константа диссоциации электролита,
— константа диссоциации электролита,  — концентрация,
— концентрация, 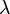 и
и 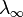 — значения эквивалентной электропроводности при концентрации
— значения эквивалентной электропроводности при концентрации  и при бесконечном разбавлении соответственно. Соотношение является следствием закона действующих масс и равенства
и при бесконечном разбавлении соответственно. Соотношение является следствием закона действующих масс и равенства

где 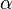 — степень диссоциации.
— степень диссоциации.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 2161; Нарушение авторских прав?; Мы поможем в написании вашей работы!