
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей
|
|
|
|
1. Соли, образованные сильным основанием и слабой кислотой.
Например, соль цианид калия KCN образована сильным основанием KOH и слабой кислотой HCN:

В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения:

2) полная диссоциация соли (сильного электролита):
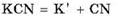
Образующиеся при этих процессах ионы Н+ и CN- взаимодействуют между собой, связываясь в молекулы слабого электролита — цианистоводородной кислоты HCN, тогда как гидроксид — ион ОН-остается в растворе, обусловливая тем самым его щелочную среду. Происходит гидролиз по анионуCN-.
Запишем полное ионное уравнение происходящего процесса (гидролиза):

Этот процесс обратим, и химическое равновесие смещено влево (в сторону образования исходных веществ), т. к. вода — значительно более слабый электролит, чем цианистоводородная кислотаHCN:
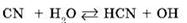
Уравнение показывает, что:
1) в растворе есть свободные гидроксид-ионы ОН-, и концентрация их больше, чем в чистой воде, поэтому раствор соли KCN имеет щелочную среду (рН > 7);
2) в реакции с водой участвуют ионы CN-, в таком случае говорят, что идет гидролиз по аниону. Другие примеры анионов слабых кислот, которые участвуют в реакции с водой:
· муравьиной HCOOH — анион HCOO-;
· уксусной CH3COOH — анион CH3COO-;
· азотистой HNO2 — анион NO2-;
· сероводородной H2S — анион S2-;
· угольной H2CO3 — анион CO32-;
· сернистой H2SO3 — анион SO32-.
Рассмотрим гидролиз карбоната натрия
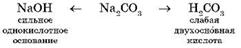
Происходит гидролиз соли по аниону CO32-. Полное ионное уравнение гидролиза:
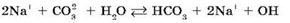
Сокращенное ионное уравнение гидролиза:
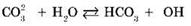
Продукты гидролиза — кислая соль NaHCO3 и гидроксид натрия NaOH.
|
|
|
ü ЗАПОМНИ. В крови и слюне содержатся соли гидрокарбонат (HCO3-) и гидрофосфат (HPO42-) натрия, которые поддерживают определенную реакцию среды за счет смещения, равновесия процессов гидролиза.
Среда водного раствора карбоната натрия — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН-. Кислая соль NaHCO3 тоже может подвергаться гидролизу, который протекает в очень незначительной степени, и им можно пренебречь.
Подведем итог тому, что вы узнали о гидролизе по аниону:
1) по аниону соли, как правило, гидролизуются обратимо;
2) химическое равновесие в таких реакциях сильно смещено влево;
3) реакция среды в растворах подобных солей щелочная (рН > 7);
4) при гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
Ступенчатый гидролиз(уравнения гидролиза в молекулярной, ионной и сокращенной ионной форме)
Рассмотрим гидролиз карбоната натрия Na2CO3. Для составления уравнений гидролиза Na2CO3 по ступеням исходим из следующего положения. Соль образована сильным основанием и слабой кислотой. Ион 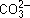 слабой кислоты будет связывать ионы водорода воды. Поскольку ион
слабой кислоты будет связывать ионы водорода воды. Поскольку ион 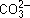 несет две единицы заряда, то следует рассматривать две ступени гидролиза. Для каждой ступени надо уметь записывать три вида уравнений: а) в сокращенной ионной форме; б) в ионной форме;
несет две единицы заряда, то следует рассматривать две ступени гидролиза. Для каждой ступени надо уметь записывать три вида уравнений: а) в сокращенной ионной форме; б) в ионной форме;
в) в молекулярной форме.
Первая ступень:
а) 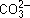 + Н2О
+ Н2О 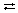
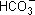 + ОН–;
+ ОН–;
б) к ионам этого уравнения приписываем ионы противоположного знака:
2Nа+ + 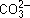 + Н2О
+ Н2О 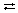 Nа+ +
Nа+ + 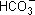 + ОН– + Nа+;
+ ОН– + Nа+;
в) записываем ионы предыдущего уравнения в виде химических формул веществ и получаем уравнение гидролиза в молекулярной форме:
Nа2СО3 + Н2О 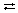 NаНСО3 + NаОН.
NаНСО3 + NаОН.
Вторая ступень:
а) 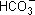 + Н2О
+ Н2О 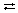 Н2СО3 + ОН–;
Н2СО3 + ОН–;
б) Nа+ + 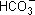 + Н2О
+ Н2О 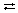 Н2СО3 + Nа+ + ОН–;
Н2СО3 + Nа+ + ОН–;
в) NаНСО3 + Н2О 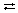 Н2СО3 + NаОН.
Н2СО3 + NаОН.
В обычных условиях гидролиз протекает главным образом по первой ступени: ионы 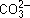 связывают ионы водорода Н+ воды, образуя сначала
связывают ионы водорода Н+ воды, образуя сначала 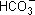 , и лишь при сильном разбавлении и нагревании следует учитывать гидролиз образовавшейся кислой соли.
, и лишь при сильном разбавлении и нагревании следует учитывать гидролиз образовавшейся кислой соли.
|
|
|
Итак, в результате гидролиза соли, образованной слабой кислотой и сильным основанием, ионы водорода Н+ (от молекул воды Н2О) образуют с ионами 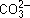 устойчивые ионы
устойчивые ионы 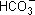 . В растворе накапливаются свободные ионы ОН–, поэтому среда становится щелочной, [Н+] < [ОН–].
. В растворе накапливаются свободные ионы ОН–, поэтому среда становится щелочной, [Н+] < [ОН–].
 Рассмотрим гидролиз хлорида алюминия AlCl3. Cоль AlCl3 образована сильной кислотой HCl и слабым основанием Al(OH)3. При гидролизе ион Al3+ будет отрывать гидроксид-ионы ОН– от молекул Н2О. Освобождающиеся катионы водорода Н+ обусловливают кислую среду раствора.
Рассмотрим гидролиз хлорида алюминия AlCl3. Cоль AlCl3 образована сильной кислотой HCl и слабым основанием Al(OH)3. При гидролизе ион Al3+ будет отрывать гидроксид-ионы ОН– от молекул Н2О. Освобождающиеся катионы водорода Н+ обусловливают кислую среду раствора.
Первая ступень:
а) Al3+ + HOH 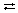 AlOH2+ + H+;
AlOH2+ + H+;
б) Al3+ + 3Сl– + H2O 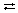 AlOH2+ + 2Сl– + H+ + Сl–;
AlOH2+ + 2Сl– + H+ + Сl–;
в) AlCl3 + H2O 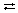 AlOHCl2 + HCl.
AlOHCl2 + HCl.
Вторая ступень:
а) AlOH2+ + H2O 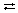
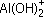 + H+;
+ H+;
б) AlOH2+ + 2Сl– + H2O 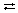
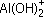 + Сl– + H+ + Сl–;
+ Сl– + H+ + Сl–;
в) AlOHCl2 + H2O 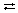 Al(OH)2Cl + HCl.
Al(OH)2Cl + HCl.
Реакция по третьей ступени практически не протекает. Ввиду накопления ионов водорода процесс смещается в сторону исходных веществ. Однако разбавление раствора и повышение температуры усиливают гидролиз. Поэтому может происходить гидролиз и по третьей ступени (здесь приведена запись только в молекулярной форме):
Al(OH)2Cl + H2O 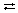 Al(OH)3 + HCl.
Al(OH)3 + HCl.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1063; Нарушение авторских прав?; Мы поможем в написании вашей работы!