
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Берілген концентрация бойынша ерітінді дайындау 2 страница
|
|
|
|
Қолданатын реактивтер мен аспаптар
а) мырыш түйіршігі;
б) мырыш, темір, қалайы, кадмий, қорғасын, мыс және күміс тұздарының ерітінділері;
в) милливольтметр, мыс-мырыш электроды, агар-агар көпіршесі
Теориялық бөлімі
Кернеу қатары металдардың химиялық активтiгiн сипаттайды. Бұл қатардан үш маңызды салдарлар шығады:
1. Неғұрлым кернеу қатарында металл солға қарай орналасқан болса, соғұрлым ол химиялық активті болады, тотықсыздандыру қабілеті жоғары, оңай тотығады және өз иондарынан қиын тотықсызданады. Мысалы: натрий металлтүрінде cыртқы бiр электронын берiп, жеңiл тотығады Na0 - 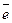 «Na+, өйткенi натрийдiң стандартты потенциалы
«Na+, өйткенi натрийдiң стандартты потенциалы  j0 = -2,71 В, ал натрийдiң катионы қиын тотықсызданады Na+ +
j0 = -2,71 В, ал натрийдiң катионы қиын тотықсызданады Na+ + 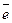 = Na0 өйткені оның стандарты потенциалы
= Na0 өйткені оның стандарты потенциалы  j0 = 2,71B тең.
j0 = 2,71B тең.
қолданбалы химия кафедрасы
Металдардың кернеу қатары
1-кесте.
| Li+/ Li0 | Cs+/ Cs0 | K+/ K0 | Ba2+/ Ba0 | Ca2+/ Ca0 | Na+/ Na0 | Mg2+/ Mg0 | Be2+/ Be0 | AI3+/ AI0 | Mn2+/ Mn0 | Zn2+/ Zn0 |
| -3,04 | - 3,01 | -2,92 | -2,90 | - 2,87 | - 2,71 | - 2,37 | - 1,85 | -1,66 | -1,19 | -0,76 |
Металл иондарының тотықтыру қасиетінің күшеюі ®
| Cr3+/ Cr0 | Fe2+/ Fe0 | Co2+/ Co0 | Ni2+/ Ni0 | Sn2+/Sn0 | Pb2+/Pb0 | H | Cu2+/ Cu0 | Ag+/ Ag0 | Hg2+/ Hg0 | Pt2+/ Pt | Au3+/ Au |
| -0,74 | -0,44 | -0,40 | -0,25 | - 0,14 | - 0,13 | 0,00 | 0,34 | 0,80 | 0,86 | 1,20 | -0,76 |
Металдар атомдарының тотықсыздандыру қасиетінің күшеюі ®
2. Кернеу қатарындағы әрбір металл өзінен кейін тұратын металдарды олардың тұздарының ерітінділерінен ығыстырады.
|
|
|
Мысалы: мыс өзінен кейін тұратын күмісті оның тұзынан ығыстырады
Cu0 + 2AgNO3 = Cu(NO3)2 + 2Ag0
3. Кернеу қатарындағы сутегінен бұрын тұратын металдардың барлығы ерітінділерден сутек ионын молекулалық түрінде ығыстырады.
Гальваникалық элемент
Гальваникалық элементте тотығу-тотықсыздандыру реакциясының энергиясы электр энергиясына айналады. Электр қозғаушы күштi тотықтырғыш пен тотықсыздандырғыш потенциалдарының айырымы арқылы табады. Кернеу қатарында металдар неғұрлым бiр-бiрiнен алыс тұрса, соғұрлым э.қ.к. жоғары болады.
Жұмыстың барысы
1-ші тәжiрибе. Металдардың кернеу қатары
Жеті пробиркаға мырыштың, темірдің(II), қалайының, кадмийдің, қорғасынның, мыстың және күмістің тұздарының ерітінділерін құйыңыз. Мырыш тұзының ерітіндісінен басқасына бірдей мырыштың грануларын салыңыз. Нені байқадыңыз? Орын алатын реациялардың теңдеулерін жазыңыз.
Мысалы: Zn0 + 2AgNO3 = Zn(NO3)2 + 2Ag0
тотықсыздандырғыш: Zn0 – 2e «Zn2+
тотықтырғыш: 2Ag+ + 2e «2Ag0
Байқаған өзгерістерді кестеге жазыңыз. Металдар бос түрінде өз тұздарынан бөлініп шыққан жағдайда ионның астында плюс, егер метал бос түрінде бөлініп шықпаса минус қойыңыз.
қолданбалы химия кафедрасы
| Ерітіндіге батырылған металл | Стандартты электродты потенциал | Ерітіндідегі металдар иондары | ||||||
| Zn2+ | Fe2+ | Cd2+ | Sn2+ | Pb2+ | Cu2+ | Ag+ | ||
| Zn0 |
Бөлініп шыққан металдарды тотықсыздандыру қабілеті төмендеген сайын бір қатарға орналастырыңыз және олардың нормалды электродты потенциалдарын көрсетіңіз. Металдардың тәжірибе арқылы алынған қатары олардың металдар кернеу қатарындағы орындарымен сәйкес келе ме?
|
|
|
2-тәжiрибе. Даниэль-Якобидің гальваникалық элементiн құру
Концентрациялары 1М ZnSО4, CuSO4 және агар-агар толтырылған U-тәрiздi көпірше, мысты және мырышты электродтарды, көлемi 50 миллилитрлiк екi химиялық стакан, штатив, милливольтметр, екi электродты бiр-бiрiмен қосу үшiн қажет болатын сым алыңыз (1 сурет).
Екi стаканның бiреуiне 20 мл ZnSО4 құйыныз да оған мырыш электродын батырыңыз, ал екiншiсiне 20 мл CuSО4 ерітіндісін құйыңыз да мыс электродын батырыңыз. Екi стаканды бiр-бiрiне тақау қойып, агар-агар құйылған U-тәрiздi көпіршемен суретте көрсетiлгендей екi стаканды қосыңыз. Екi электродты сыммен милливольтметрмен қосыңыз.
Электр тоғының пайда болғанын милливольтметр стрелкасының қозғалғанынан байқайсыз.
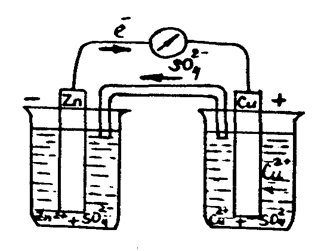
1 - сурет - Мыс-мырышты гальваникалық элементi.
қолданбалы химия кафедрасы
Жұмысты өңдеу
1. Мысты-мырышты гальваникалық элементтiң схемасын салыңыз.
2. Мырышты анодта тотығу, мысты катодта тотықсыздандыру жүретін процестердің теңдеулерін жазыңыз. Гальваникалық элементте жүретін тотығу– тотықсыздандыру процесінің жалпы теңдеуін жазыңыз.
3. Гальваникалық элементтің электр қозғаушы күшiн есептеңiз.
Бақылау сұрақтары:
1. Күмісті AgNO3 ерітіндісінен ығыстыру үшін қандай металдарды алуға болады?
2. Қандай металдар және қандай реттілікпен ығысады, егер қорғасынды пластинканы темір (II), магний, мыс (II), сынап(II), және күміс нитраттарының ерітінділеріне батырылған болса? Жүретін реакциялардың теңдеулерін жазыңыз.
Қолданбалы химия кафедрасының
26.08.2014 ж. отырысында
№1 бұйрықпен бекітілді
қолданбалы химия кафедрасы
№ 10 зертханалық жұмыс
Тұздардың электролизi

Жұмыстың мақсаты
Сулы ерітінділердегі электролиттердің
электролизімен танысу, электродтық потенциалды есептеу.
Жұмыстың мазмұны
|
|
|
а) Мыс сульфаты ерiтiндiсiнiң электролизi.
б) Калий иодидінің электролизі.
Қолданатын реактивтер мен аспаптар
а) мыс сульфаты, калий иодиді тұздарының ерітінділері;
б) электролиз процесi жүретiн аспап
Теориялық бөлімі
Электролиттің ерітіндісі немесе балқымасы арқылы электр тоғы өткенде жүретін тотығу – тотықсыздандыру процесі электролиз деп аталады.
Электролиз жүргізетін аспап ішіне екі еритін немесе ерімейтін электродтар батырылған электролиттің ерітіндісінен тұрады. Электродтың біреуі сыртқы тоқ көзінің оң полюсына ал екіншісі теріс полюсына қосылады (1-сурет)

1 - сурет - Электролиз процесi жүретiн аспап
Электролиттің табиғатына және электродтың материалына байланысты электролиздің үш түрін ажыратады:
Электролиттің табиғатына және электродтың материалына байланысты электролиздің үш түрін ажыратады:
1) индифферентті электродтарда жүретін тұздың сулы ерітіндісінің электролизі;
2) тұздың балқымасының электролизі;
3) еритін электродта жүретін электролиз немесе металдарды тазарту.
1. Графитті электродтарда жүретін натрий хлоридінің судағы ерітіндісінің
қолданбалы химия кафедрасы
электролизін қарастырайық.
Төменгi схема бойынша катодта сутек ионы тотықсызданып, сутегi молекуласы түзіледі, ал анодта судың молекулалары тотығып оттек бос түрде бөлініп шығады.









Катодты кеністікте натрий гидроксидi, ал анодты кеңістекте тұз қышқылы түзіледі.
1. Натрий хлоридінің балқымасының электролизі.
Электролиз процесі келесі схема бойынша жүреді:
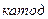






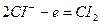

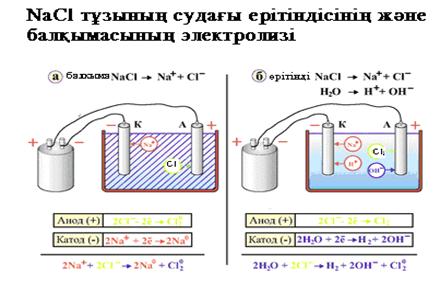
Катодта натрий тотыксызданады, ал анодта хлор тотығады.
Электролиз процесі сандық жағынан Фарадей заңымен сипатталады:

мұнда: m – бөлініп шыққан заттың массасы, г
I - тоқ күші, A
t – уақыт, сек
96500 – Фарадей саны
Э – бөлініп шығатын заттың эквиваленттік массасы
|
|
|
қолданбалы химия кафедрасы
Жұмыстың барысы
1- тәжiрибе. Мыс сульфаты ерiтiндiсiнiң электролизi
Электролизерге мыс сульфатының ерiтiндiсiн құйыңыз. Оған графиттен жасалған электродтарды батырып, ерітінді арқылы электр тоғын өткізіңіз.Тәжiрибенi 2-3 минут жүргiзiңiз. Катодта қандай өзгерiс байқалады? Екi электродтарда жүретiн процестерді көрсетiңiз. Анодта қандай газ бөлiнедi?
2-тәжiрибе. Калий йодидiнiң электролизi
Пробирканың 3/4 бөлiгiне KI ерiтiндiсiн құйып, оған 5-6 тамшы фенолфталеин және крахмал ерiтiндiсiн қосыңыз. Ерiтiндiнi араластырып электролизерге құйыңыз. Электролизерге графиттен жасалған электродтарды батырып, ерітінді арқылы электр тоғын өткізіңіз. Катодта неге калий бос түрде бөлiнбейдi? Калий, сутегi, йод және оттегiнiң тотығу-тотықсыздандыру потенциалдарын салыстырыңыз. Катодты кеңістікте ерітіндінің түсі қоңыр қызыл түске боялуы электролиз процесі жүргенде қандай иондардың пайда болуымен байланысты. Анодты жєне катодты процестердің теңдеулерін жазыңыз? Анодты кеңістектегі ерітіндінің көгеруін қалай түсіндіруге болады?
Жұмысты өңдеу
Лабораториялық дәптерге электролиз схемасын салып, анодтық және катодтық процесті көрсетіп, тотығу-тотықсыздану реакцияларын жазыңдар.
Бақылау сұрақтары:
1. Кальций хлориді ерітіндісінің электролизін өткізгенде, катодта 5,6 г сутек бөлініп шықты. Қандай газ анодта бөлініп шықты? Бөлініп шыққан газдың массасы қаншаға тең?
2. Қорғасын бромидінің балқымасы арқылы 30 минут 3А тең тоқ өткізгендегі катодта бөлініп шыққан қорғасынның массасын есептеңіз.
Қолданбалы химия кафедрасының
26.08.2014 ж. отырысында
№1 бұйрықпен бекітілді
қолданбалы химия кафедрасы
№11 зертханалық жұмыс
Металдардың коррозиясы

Жұмыстың мақсаты
Коррозияның пайда болуы, химиялық коррозияға әсер ететін факторларды қарастыру.
Жұмыстың мазмұны
а) болаттың бетіндегі электрхимиялық құбылыстар;
б) көміртектің темірмен жанасу кезіндегі коррозиясы
в) хлор ионының активтендіру қасиеті.
Жұмыстың теориялық негізі
Корозия дегеніміз сыртқы ортаның химиялық және электрохимиялық әсерінен металдардың бұзылуы. Коррозия процесінің жүру механизміне байланысты ол екіге жіктеледі: химиялық және электрохимиялық. Химиялық коррозия дегеніміз металдың сыртқы ортамен химиялық әрекеттесуінен бүлінуі. Темір және оның құймаларынан жасалған бұйымдар ауада күн сәулесі әсерінен су буы және оттегімен химиялық әрекеттесуге ұшырайды:
4Fe + 6H2O + 3O2 = 4Fe(OH)3
Тотықсыздандырғыш {Fe0 – 3e → Fe3+ / 12 4 тотығады
Тотықтырғыш { 3O2 + 12e → 2O32- / 3 1 тотықсызданады
t
2Fe(OH)3 → Fe2O3 + 3H2O
Fe2O3 – қоңыр қызыл түсті. Егер металл құймалардан жасалған бұйымдардың бетінде қоңыр қызыл дақ түссе, ол коррозияның белгісі. Оны болдырмаудың шараларын жасау керек..
Электрохимиялық коррозия дегеніміз – сыртқы орта әсерінен гальваникалық жұп түзілу нәтижесінде металдың бүлінуі.
Егер электролит ерітіндісіне, мысалы, күкірт қышқылына екі металл пластинканы салып, оларды бір-біріне жақындатсақ, гальваникалық элемент түзіледі.
қолданбалы химия кафедрасы
Гальваникалық элементте теріс электродта тотығу процесі жүреді. Ал коррозия дегеніміздің өзі тотығу процесі. Сонымен,
· электрохимиялық коррозия кезінде активтірек металл бұзылады.
Мырыш-мыс пластинкасында - мырыш коррозияға ұшырайды.
Zn0 - 2e- → Zn2+
Оң электродта тотықсыздану процесі өтеді. Ерітіндіде Н+ болғандықтан мыс пластинкада сутек ионы тотықсызданады:
2H+ + 2e- → H2
Демек, электрохимиялық коррозия кезінде қышқыл орта болса, активтілігі нашар металдың бетінде сутегі түзіледі.(31-сурет)

Мырышты - мыс пластинкасы натрий хлориді немесе теңіз суына батырылды десек, онда бұл жағдайда мырыш коррозияға ұшырайды. Ал мыс пластинканың бетінде сутегі газ күйінде бөлінбейді. Себебі, бейтарап ортада сутегі ионы тотықсыздануға концентрациясы аз болғандықтан, бұл жағдайда тотықтырғыш ролін суда еріген оттегі атқарады:
О2 + Н2О + 4е- → 4ОН-
Сонымен, мыс пластинкасының маңайында ерітінді сілтіленеді. Коррозия нәтижесінде түзілген мырыш ионы гидроксид ионымен қосылып, мырыш гидроксидін түзеді:
Zn2+ + 2 OH- → Zn (OH)2
Ойымызды жинақтасақ, электрохимиялық коррозия бейтарап ортада жүрсе, онда активтілігі нашар металдың маңайында оттегі тотықсызданып, гидроксид ион түзеді.
қолданбалы химия кафедрасы
Коррозиялық процестегі көп таралған тотықтырғыш көбінесе сутегі ионы мен оттегі молекуласы. Сутегі ионы қатысындағы электродтық процестердің теңдеуі:
M – n e- ® Mn+
2H+ + 2 e- ® H2
Сутегі бөлінуі арқылы жүретін коррозия металға қарағанда сутегі электродының потенциялы оң болған жағдайда ғана орындалады. Бұл жағдайда коррозия жылдамдығы сутегі газының бөліну жылдамдығына, металдың табиғатына, сутегі бөлініп жатқан металдың беттік ауданына тәуелді болады.
Оттегі молекуласы қатысындағы электродтық процестердің теңдеуі:
M – n e- ® Mn+
O2 +2H2O + 4e- ® 4OH-
Оттегі жұтылуы арқылы жүретін коррозия металға қарағанда оттегі электродының потенциялы оң болған жағдайда ғана орындалады. Бұл жағдайда коррозия жылдамдығы оттегі газының диффузиялану жылдамдығына, демек ерітіндідегі еріген оттегінің концентрациясына тәуелді болады.
Жұмыстың жүру барысы
1-тәжірибе. Болаттың бетіндегі электрохимиялық құбылыстар
Болаттың бетінде тотықтырғыштардың әсерінен электрохимиялық коррозия байқалады. Бұл процестің нәтижесінде темірдің анодты қеруі іске асады. Темірдің ерігенін турнбуль көгімен индикатор қатысында темір(ІІ) ионының әрекетесуінен білеміз.
Тәжірибені жүргізу үшін болат пластинканың бетін қайрақпен немесе наждак қағазымен тазалап, сумен жуыңдар, фильтр қағазымен суын сорғытып, кептіріңдер. Одан кейін ферроксилиндикаторға матырылған фильтр қағазын қойыңдар. Ферроксилиндикатордың құрамы: 100 см3 су + 3 г ас тұзы + 0,1 г (K3[Fe(CN)6] + бірнеше тамшы фенолфталеин
2-3 минуттан кейін фильтр қағазындағы түстің өзгеруін, дақтың пішінін, оның таралуын бақылаңдар. Реакциялардың электродтық потенциалына сүйеніп, өзгерістерді түсіндіріңдер. Қажетті теңдеулерді жазыңдар.
2-тәжірибе. Бейтарап ортадағы электрохимиялық коррозия.
Екі пробиркаға ас тұзы ерітіндісін құйып, оған мырыш пен мысты жанастыра орналастырамыз. Бір екі тамшы фенолфталеин қосыңдар. Не байқадыңыздар? Катодтық және анодтық үрдісті жазыңдар.
3-тәжірибе. Хлор ионының активтендіру қасиеті.
Екі пробиркаға мыс сульфатының сірке қышқылы қосылған ерітіндісін құйыңдар. Олардың біреуіне натрий хлоридін қосыңдар. Одан кейін екі пробиркаға да алюминий сынығын салыңдар. Қайсы пробиркада белсенді түрде газ бөлінеді?
қолданбалы химия кафедрасы
Анодтық, катодтық және қосынды процестердің теңдеулерін жазыңдар. Хлор ионының реакция жылдамдығына әсерін түсіндіріңдер.
Жұмысты өңдеу
Әрбір тәжірибеде жүретін коррозиялық процесті бақылап, олардың қажетті теңдеулерін жазыңдар. Катодтық және анодтық процестің теңдеулерін жазып, коррозияның жылдамдығы неге тәуелді болатынын сипаттап жазыңдар.
Бақылау сұрақтары
1. Металдар коррозиясы дегеніміз не?
2. Коррозияның түрлері қандай?
3. Химиялық коррозия мен электрохимиялық коррозияның айырмашылығы неде?
4. Сутегі бөлінуі арқылы жүретін коррозиялар, ол неге тәуелді?
5. Оттегі жұтылуы арқылы жүретін коррозия, оның жылдамдығы неге тәуелді?
Қолданбалы химия кафедрасының
26.08.2014 ж. отырысында
№1 бұйрықпен бекітілді
қолданбалы химия кафедрасы
№ 12 зертханалық жұмыс
КОМПЛЕКСТІ ҚОСЫЛЫСТАР
Жұмыстың мақсаты
Комплекс қосылыстардың химиялық қасиеттерін, оларды алу әдістерін, комплекстердің тұрақтылығын анықтау. Қос тұздарды комплекс тұздардан айыра білу.
Жұмыстың мазмұны
1. Анионды комплекс қосылыстың түзілуі.
2. Катионды комплекс қосылыстың түзілуі.
3. Қос комплекс ионды қосылысты алу.
4. Fe2+ және Fe3+ иондарын анықтау үшін реакциялар жүргізу.
Теориялық бөлім
Молекулаларды өзіне тартып немесе қарама-қарсы зарядталған иондардың күрделі иондарға айналуын комплексті иондар дейді. Комплексті иондардың құрамына кіретін заттар комплексті қосылыстар деп аталады.
Комплексті қосылыстар құрамында бір немесе бірнеше донорлы-акцепторлы байланыс болатын жоғары ретті қосылыстар. Швейцария ғалымы Альфред Вернер (1893 ж.) ұсынған координациялық теориясының негізгі қағидалары:
1. Комплексті қосылыстардағы басты орын комплекстүзушінің үлесіне тиеді. Комплекстүзуші оң зарядталған металл иондары бар.
2. Комплекстүзушінің маңайына теріс зарядталған аниондар лигандалар орналасады.
3. Лигандалардың жалпы саны комплекстүзушінің координацияланған саны деп аталады.
4. Комплекстүзуші мен лигандалар ішкі сфераны түзеді.
5. Ішкі сфераға симай қалған иондар комплексті қосылысының сыртқы сферасын түзеді.
Қолданылатын реактивтер
Висмут(III) нитраты, калий иодиді, мыс сульфаты, калий гексацианоферраты(ІІІ) – (қызыл қан тұзы), темір(ІІІ) хлориді, темір(ІІ) сульфаты, Мор тұзы – (NH4)2SO4*FeSO4, K4[Fe(CN)6] – калий гексацианоферраты (ІІ) – (сары қан тұзы) тұзадырының ерітіндісі.
Жұмыстың барысы
1-тәжірибе. Аниондық комплекс қосылыстың түзілуі
Калий тетраиодовисмутатын алу.
2-3 мл висмут (III) нитраты бар пробиркаға калий иодидінің ерітіндісін тұнба түскенше тамшылатып құйыңыз. Тұнбаның түсі қандай? Содан соң тұнбаға 2-3мл калий иодидінің ерітіндісін тұнба толық еріп кеткенше құйыңыз. Ерітіндіде калий тетраиодовисмутаты түзіледі. Реакция теңдеуін жазыңыз.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 2459; Нарушение авторских прав?; Мы поможем в написании вашей работы!