
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первый закон термодинамики. Первый закон термодинамики – это закон сохранения энергии в изолированной системе
Первый закон термодинамики – это закон сохранения энергии в изолированной системе.
Теплота Q, переданная системе, идёт на увеличение её внутренней энергии ΔU и на совершение работы системой против внешних сил:
Q = ΔU + A (1)
Для бесконечно малого изменения величин:
δQ = dU + δA, (2)
бесконечно малое изменение функций состояния принято обозначать буквой d, а функций процесса – δ.
Внутренняя энергия - это общий запас энергии системы. Она включает в себя все виды энергии системы (энергию движения и взаимодействия молекул, атомов, ядер и др. частиц, внутриядерную и др. виды энергии), кроме кинетической энергии движения системы, как целого, и потенциальной энергии её положения. Абсолютную величину внутренней энергии измерить нельзя, можно определить её изменение при переходе системы из начального состояния в конечное. Внутренняя энергия представляет собой способность системы к совершению работы или передачи тепла.
 (3)
(3)
При увеличении внутренней энергии ΔU>0, при уменьшении ΔU<0.
Работа процесса – это энергия, передаваемая одним телом другому при их взаимодействии. В химической термодинамике обычно рассматривают работу расширения газа А = р · ΔV. Если система совершает работу, то величина А положительна, так как
ΔV = 
Поскольку работа является функцией процесса, то её изменение
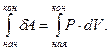 (4)
(4)
Для изохорных процессов, т.е. процессов, протекающих при постоянном объёме (V=const, dV=0):
δQv = dU, Qv = ΔU. (5)
Для изобарных процессов, протекающих при постоянном давлении (p=const, dp=0), выражение первого закона термодинамики можно преобразовать, если использовать функцию состояния системы, называемую энтальпией. Энтальпия H, как и внутренняя энергия, не зависит от пути процесса, характеризует полную энергию системы и «теплосодержание»:
H = U + pV;
dH = dU + d(pV) = dU + pdV + Vdp; (6)
при р=const, dp=0, Vdp=0
δQp = dU + pdV = (dH – pdV) + pdV = dH,
Qp = ΔH (7)
Для изотермических процессов,протекающих при постоянной температуре (T = const и U = const, dU = 0)
δQ = δA, Q = A. (8)
Для адиабатных процессов, при которых нет теплообмена системы с окружающей средой (δQ = 0):
δA = - dU, A = - ΔU. (9)
|
|
Дата добавления: 2014-12-16; Просмотров: 395; Нарушение авторских прав?; Мы поможем в написании вашей работы!