
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адсорбционная очистка газов
|
|
|
|
При физической абсорбции происходит физическое растворение абсорбируемого компонента в растворителе, не сопровождающееся химическими реакциями. Абсорбция происходит только в том случае, если парциальное давление абсорбируемого компонента в газовой фазе больше равновесного парциального давления этого компонента над раствором. Чем больше разница давлений, тем больше движущая сила процесса и тем с большей скоростью протекает абсорбция.
При хемосорбции молекулы абсорбтива вступают в химическое взаимодействие с молекулами активного компонента абсорбента, образуя новое химическое соединение в жидкой фазе. При этом равновесное парциальное давление извлекаемого компонента над раствором значительно ниже (меньше), чем при физической абсорбции, поэтому хемосорбционный процесс более полно извлекает компонент из газовой фазы
В качестве абсорбента (поглотителя) может быть использована любая жидкость, в которой растворили извлекаемый из газового потока компонент (загрязняющее вещество).
Универсального абсорбента, удовлетворяющего всем требованиям, нет, поэтому выбирают обычно абсорбент, наиболее полно удовлетворяющий ряду требований.
Большинство реакций является экзотермическими и обратимыми, поэтому процесс регенерации (десорбции) легко произвести путем повышения температуры жидкости и образовавшееся химическое соединение легко разлагается на исходные продукты.
Регенерацию поглотителя можно осуществлять также путем понижения давления или сочетая эти оба метода.
Сочетание процесса абсорбции с десорбцией позволяет многократно использовать жидкий поглотитель в замкнутом контуре: абсорбция – десорбция – абсорбция и выделять поглощаемый компонент в чистом виде, не загрязняя окружающую среду.
|
|
|
Закон сохранения массы.
В покоящейся системе законы сохранения массы и энергии означают, что
внутри системы они могут превращаться, оставаясь в совокупности неизменными. Если система состоит из нескольких компонентов и одной фазы, то сумма масс всех компонентов должна быть равна массе всей системы (закон сохранения массы): 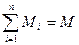 . Если в системе несколько фаз, то
. Если в системе несколько фаз, то 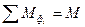
Согласно закона сохранения веществ масса (количество) поступающих на переработку веществ 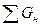 должно быть равно массе веществ, получаемых в результате проведения процесса
должно быть равно массе веществ, получаемых в результате проведения процесса 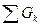 :
: 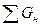 =
= 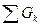 .
.
На практике 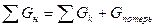 .
.
Рассмотрим процесс поглощения газа жидкостью. Количество компонента (аммиака), переходящего из газовой фазы в жидкую:
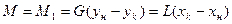 ,
,
где: G и L – расход инертного газа и жидкости, кмоль/с; 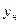 ,
, 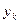 - концентрация компонента газа, кмоль/кмоль;
- концентрация компонента газа, кмоль/кмоль; 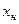 ,
, 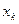 - концентрация компонента жидкости, кмоль/кмоль.
- концентрация компонента жидкости, кмоль/кмоль.
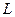 ,
, 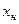
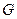 ,
, 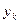
Запишем материальный баланс
 y для сечения I – I:
y для сечения I – I:
противоток 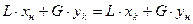
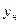 или
или
I I 
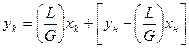
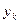 поскольку
поскольку 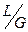 - const, а второй
- const, а второй
член правой части уравнения (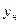 )
)
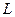 ,
, 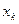
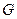 ,
, 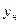
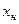
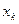 x также является величиной
x также является величиной
постоянной, получим:
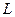 ,
, 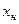
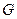 ,
, 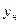
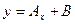 ,
,
y прямоток где:
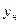
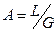 - тангенс угла наклона прямой линии;
- тангенс угла наклона прямой линии;
B – отрезок отсекаемых на оси ординат прямой линии.
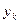
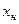

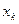 x
x
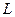 ,
, 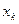
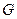 ,
, 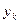 Для прямотока
Для прямотока 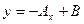 .
.
Расход абсорбента: 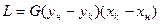 ; или его удельный расход:
; или его удельный расход: 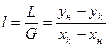 . Уравнение
. Уравнение 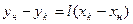 - уравнение рабочей линии, определяет зависимость между составами газа и жидкости в произвольном сечении аппарата. Из уравнения следует, что рабочая линия абсорбции в координатах y – x представляет собой прямую с углом наклона, тангенс которого равен
- уравнение рабочей линии, определяет зависимость между составами газа и жидкости в произвольном сечении аппарата. Из уравнения следует, что рабочая линия абсорбции в координатах y – x представляет собой прямую с углом наклона, тангенс которого равен 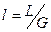 .
.
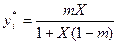
Состояние равновесия между концентрацией газа в газовой и жидкой фазах характеризуется константой фазового равновесия (коэффициентом распределения), которая равна отношению концентрации компонента в газовой фазе к его концентрации в жидкой фазе.
В зависимости от способа выражения концентраций, константа фазового равновесия может быть определена:
|
|
|
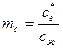 ,
, 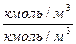 ;
; 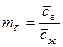 ;
; 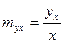 ;
; 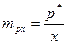 , Па/моль
, Па/моль
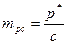 ,
, 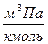 ;
; 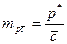 ,
, 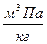 .
.
Сведения о растворимости газов 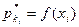 , определенные опытным путем, приведены в справочниках.
, определенные опытным путем, приведены в справочниках.
В технологических расчетах могут быть применимы законы для идеальных растворов: а) закон Рауля – при температурах ниже критических:
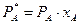 ,
,
где: 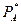 - парциальное давление компонента в газовой фазе над жидкостью в условиях равновесия;
- парциальное давление компонента в газовой фазе над жидкостью в условиях равновесия;
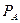 - давление насыщенного пара чистого компонента А при данной температуре;
- давление насыщенного пара чистого компонента А при данной температуре;
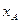 - мольная доля компонента А в жидкой фазе.
- мольная доля компонента А в жидкой фазе.
б) закон Генри - для систем “жидкость - газ” при температурах газа выше критических, когда концентрация растворенного компонента мала (менее 10%), а температура и давление далеки от критических значений:
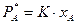 ,
, 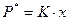 ,
, 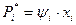 ,
,
где: 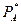 - парциальное давление компонента в газовой фазе над жидкостью в условиях равновесия;
- парциальное давление компонента в газовой фазе над жидкостью в условиях равновесия;
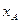 - мольная доля компонента в жидкой фазе;
- мольная доля компонента в жидкой фазе;
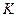 - коэффициент Генри, изменяется с температурой и зависит от природы газа и растворителя, имеет размерность давления (Павлов К.Ф., табл. XLII).
- коэффициент Генри, изменяется с температурой и зависит от природы газа и растворителя, имеет размерность давления (Павлов К.Ф., табл. XLII).
Так как 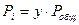 , то уравнение
, то уравнение 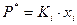 можно представить в виде
можно представить в виде
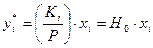 ;
; 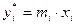 ;
; 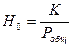 ;
;
где: 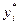 - мольная доля компонента в газовой фазе, равновесной с жидкой;
- мольная доля компонента в газовой фазе, равновесной с жидкой;
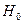 - безразмерная константа фазового равновесия, постоянная при
- безразмерная константа фазового равновесия, постоянная при 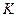 -const и
-const и 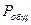 -const.
-const. 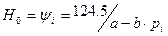
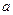 ,
, 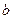 - коэффициенты зависящие от температуры;
- коэффициенты зависящие от температуры;
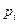 - парциальное давление в газе, Мпа.
- парциальное давление в газе, Мпа.
Если концентрация в 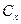 в
в 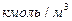 , то:
, то:
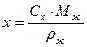 , подставим это выражение в уравнение
, подставим это выражение в уравнение 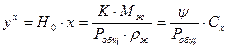 ;
;
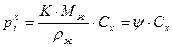 .
.
Так как растворимость многих газов значительно отклоняется от закона Генри, то при расчетах можно использовать экспериментальные опытные данные парциального давления:
Метод основан на способности некоторых твердых тел избирательно поглощать газообразные компоненты из газовых смесей. Присутствующие в газовой смеси молекулы загрязненного газа или пара собираются на поверхности или в порах твердого материала. Поглощаемое из газовой фазы вещество ─ называется адсорбтивом, а твердое вещество, на поверхности или порах которого происходит адсорбция поглощаемого вещества – адсорбентом. Газовая фаза, в которой находится извлекаемый компонент – газ – носитель, а после того, как извлеченный компонент перешел в адсорбированное состояние, его называют адсорбатом.
Применяют в этом случае:
|
|
|
1) когда другие методы оказываются неэффективны;
2) концентрация загрязняющих веществ очень мала и требуется гарантированная рекуперация извлекаемой примеси из-за ее значительной стоимости или опасности. Методом адсорбции из отходящих газов удаляют SO2 ,углеводороды, хлор, сероводород, сероуглерод, и другие.
Явление адсорбции обусловлено наличием сил притяжения между молекулами адсорбента и адсорбтива на границе раздела соприкасающихся фаз. Переход молекул загрязняющих веществ из газа – носителя на поверхностный слой адсорбента происходит в том случае, если силы притяжения адсорбента больше сил притяжения действующих на адсорбтив со стороны молекул газа – носителя. Молекулы адсорбированного вещества, переходя на поверхность адсорбента, уменьшают его энергию, в результате чего происходит выделение теплоты, примерно 60 кДж/моль (небольшая). Силы притяжения имеют разную - физическую или химическую и, следовательно, различают:
Физическую адсорбцию – при которой взаимодействия молекул загрязняющих веществ с поверхностью адсорбента определяется слабыми дисперсными, индукционными силами (силы Ван – дер – Вальса). При этом адсорбированные молекулы не вступают в химическое взаимодействие с молекулами адсорбента и сохраняют свою индивидуальность.
Для физической адсорбции характерна высокая скорость процесса, малая прочность связи и малая теплота. С повышением температуры количество физически адсорбированного вещества уменьшается, а увеличение давления к возрастанию величины адсорбции. Преимущество – легкая обратимость процесса путем:
а) уменьшения давления
б) увеличения температуры. Адсорбированные молекулы легко десорбируются без изменения химического состава, а регенерированный адсорбент может использоваться многократно. Процесс можно вести циклично, чередуя стадию поглощения и выделения извлекаемого компонента.
Химическая адсорбция – в основе лежит химическое взаимодействие между адсорбентом и адсорбируемым веществом. Действующие при этом силы значительно больше, а высвобождающееся тепло совпадает с теплом химической реакции и составляет 20 – 400 кДж/моль.
|
|
|
Главные отличия:
1)молекулы адсорбтива, легко вступив в химическое взаимодействие, прочно удерживаются на поверхности и в порах адсорбента;
2)скорость реакции, при низких температурах мала, но возрастает с ростом температуры.
Оба вида адсорбции сопутствуют друг другу, однако, наибольшее значение для очистки газов имеет физическая адсорбция.
Промышленные адсорбенты. Любое твердое тело обладает поверхностью и, следовательно, потенциально является адсорбентом.
В технике используют адсорбенты с сильно развитой внутренней поверхностью, полученной в результате (спекания), синтеза и специальной обработки.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1278; Нарушение авторских прав?; Мы поможем в написании вашей работы!