
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ю.И. Категоренко 6 страница
|
|
|
|
 ;
;
 .
.
Предлагаем читателю получить эти формулы самостоятельно.
При полном несмачивании включения сплавом (q = p) имеем сферический зародыш. При этом Δ Gmах = 4p(R*)2/3s2-3. При полном смачивании (q = 0) ΔGmах = 0. Сравним работу образования зародыша на включении при 0 < q < 180° с работой гомогенного образования сферического зародыша:
 <1 при 0 < q < p.
<1 при 0 < q < p.
Таким образом, работа образования критического зародыша на включении меньше, чем в гомогенном расплаве. СВЦК при этом вычисляется по ранее приведенным формулам, если вместо Δ Gmах в них подставлять полученное выше выражение для расчета максимального изменения энергии Гиббса при образовании зародыша на включении. Так как Δ Gmах при этом меньше, чем при гомогенном зарождении, то СВЦК при наличии включений увеличивается. Очевидно, что Δ Gmах становится меньше с уменьшением q, т. е. с усилением смачиваемости включения сплавом. Поэтому СВЦК увеличивается с уменьшением q.
Следует отметить, что не любые твердые включения резко увеличивают СВЦК. Из приведенных выражений видно, что это произойдет, если малы значения q и s2-3. Очевидно, что s2-3 будет тем меньше, чем ближе кристаллическая структура включения к кристаллической структуре зародыша. По правилу ориентационно-размерного соответствия, предложенного П. Д. Данковым и С. Т. Конобеевским, необходимо, чтобы включения имели один тип кристаллической решетки со сплавом. При этом параметры решеток не должны сильно отличаться. Такие включения называют изоморфными. Указанное правило было обосновано П.Д. Данковым следующим образом. На подкладке может образоваться ориентированный относительно ее решетки зародыш (он является как бы продолжением решетки включения) или произвольно ориентированный зародыш (как при гомогенной кристаллизации). Если параметры решеток различаются, то решетка зародыша, взаимодействуя с атомами решетки включения, упруго деформируется (расширяется или сжимается со сдвигом).
|
|
|
Если работа деформации меньше энергии образования трехмерного неориентированного зародыша, то зародышеобразования на включении не произойдет. Выполнив соответствующие расчеты для хлористого натрия, П. Д. Данков нашел, что ориентированное зарождение прекращается при различии в параметрах решеток соли и включения, равном 9 %. Практическая проверка формулы Данкова показала, что она дает завышение предельно допустимого отклонения параметров решеток. Практически при кристаллизации соли хлористого натрия на галените ориентированное зарождение прекращалось при Δ а/а = 5,7 %. В качестве примеров ориентированного зарождения центров кристаллизации металлических расплавов можно привести рост медных кристаллов (а = 3,6Å) на никелевых включениях (а = 3,52Å), кристаллов a-латуни (а = 3,68Å) на серебре (а = 4,08Å). Измельчение кристаллического зерна в отливках вследствие увеличения СВЦК путем введения в расплав изоморфных

Рис. 2.9. Зависимость числа кристаллических зерен на единице площади шлифа от перегрева металла
примесей широко применяется на практике и называется модифицированием первого рода. Например, при введении в жидкий алюминий титана или циркония образуются тугоплавкие интерметаллические соединения TiAl3 и ZrА13, имеющие изоморфную с алюминием кристаллическую решетку. Достаточно ввести в сплав десятые доли процента титана или циркония, как размер кристаллического зерна уменьшается в десятки и сотни раз.
Затравочное действие твердых включений зависит от термовременной обработки расплава. На рис. 2.9 приведена зависимость числа кристаллических зерен N на единицу площади шлифа от температуры обработки жидкого сплава. Видно, что с ростом температуры перегрева сплава N уменьшается. Начиная с некоторой, хотя и очень высокой, температуры, ниспадающая кривая переходит в восходящую. Увеличение СВЦК при высоких перегревах объясняется тем, что при этом дезактивированы все включения и сплав кристаллизуется по гомогенному механизму в условиях очень больших переохлаждении.
|
|
|
Очевидно, что если в расплаве содержится большое число истинно изоморфных примесей, то их дезактивация при перегреве не происходит.
При увеличении перегрева сплава кроме отмеченных выше явлений может происходить растворение включений в расплаве или, наоборот, выделение их из расплава. В зависимости от характера выделяющихся или растворяющихся включений изменяется кристаллическая структура сплава. Например, при перегреве магниевых сплавов, легированных алюминием, марганцем и железом, при некоторой температуре происходит растворение алюминиево-железистых соединений в расплаве. При охлаждении сплава в процессе кристаллизации эти соединения выделяются из расплава в виде компактных изоморфных частиц, что увеличивает СВЦК и измельчает структуру. Этот прием широко применяется в практике магниевого литья и носит название модифицирования перегревом. При перегреве чугуна происходит полное растворение углерода, что по аналогичным перегреву магниевых сплавов причинам приводит к резкому увеличению дисперсности выделяющихся при кристаллизации чугуна включений графита.
В заключение отметим, что при кристаллизации на примесях сохраняется характер изменения СВЦК с уменьшением переохлаждения. Однако при этом резко сокращается интервал метастабильности и повышается количественный уровень СВЦК. Это объясняется не только непосредственным влиянием переохлаждения на работу образования и размер критического зародыша, но и увеличением числа неизоморфных включений, удовлетворяющих сформулированному выше условию ориентированного роста.
Действительно, по данным Д. Тернбала и Б. Воннегута, энергия упругого деформирования кристалла на подкладке может
быть оценена по формуле Δ G = (авкл + aм)2/a2м, а движущая процесс разность энергий Гиббса при увеличении переохлаждения возрастает. Поэтому при увеличении переохлаждения все большее число включений удовлетворяет условию ориентированного зарождения.
|
|
|
ГЛАВА 2.3. МЕХАНИЗМ И КИНЕТИКА РОСТА КРИСТАЛЛИЧЕСКИХ ЗАРОДЫШЕЙ
Образовавшиеся центры кристаллизации самопроизвольно увеличивают свои размеры. Кристалл растет путем присоединения к нему атомов из окружающего расплава. Способ присоединения атомов к поверхности растущего зародыша определяется строением поверхности раздела фаз, распределением и количеством дефектов на этой поверхности. В соответствии с современной теорией кристаллизации механизм роста кристаллов определяется состоянием поверхности их граней. В зависимости от этого фактора можно выделить следующие механизмы роста кристаллов.
1. Рост кристаллов на атомно-гладких поверхностях кристалла. В этом случае все атомы поверхности раздела кристалл — расплав расположены на одной плоскости, на которой нет образований адсорбированных атомов типа уступов, ступеней и т. п. Образование уступов, ступеней, выступов из групп атомов называется процессом огранки поверхности, которая при этом называется ограненной.
При атомно-гладкой поверхности зародыша (рис. 2.10, а) возможен только послойный рост кристалла путем образования на гранях двумерных зародышей, которые разрастаются
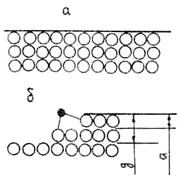

Рис. 2.10. Типы морфологии поверхности растущего Рис. 2.11. Рост кристалла путем присоединения
кристалла: а — атомно-гладкая поверхность; отдельных атомов (а) и двумерных зародышей (б)
б — ограненная поверхность
затем вдоль этих граней. Рост путем присоединения отдельных атомов в данном случае энергетически неустойчив, так как каждый адсорбированный поверхностью атом имеет только одного ближайшего «соседа» и, следовательно, только одну связь (рис. 2.11, а). В таких условиях он не может устойчиво закрепиться на поверхности. Поэтому рост может происходить только путем образования и закрепления тонких, одно-, двух- и трехатомных по толщине, плоских образований атомов, называемых двумерными зародышами.
|
|
|
На рис. 2.12 приведена схема двумерного зародыша на грани растущего кристалла. При образовании такого зародыша поверхность кристалла увеличивается на Δ S = 4×2x×d = 8x×d, т. е. на величину поверхности четырех боковых граней. Соответствующее возрастание поверхностной энергии равно As = 8xds = 8×xs', где s' = `ds — поверхностная энергия, приходящаяся на единицу периметра зародыша толщиной d. Если энергию Гиббса зародыша с основанием 1 см2 обозначить j2, а энергию Гиббса, приходящуюся на то же число атомов жидкости, — j1, то для полного изменения энергии при зародышеобразовании можно написать следующее выражение:
 .
.

Рис. 2.12. Схема образования двумерного зародыша на грани кристалла
Подставив в это выражение Δ j = j1 — j2 = Δ H`× Δ T/Ткр (см. гл. 2.1), где Δ H' — теплота плавления зародыша с основанием 1 см2, получаем
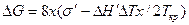 .
.
 ;
;  .
.
Исследуем эту зависимость на экстремум:
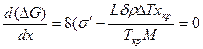 .
.
Из этого уравнения находим выражение для вычисления критического размера зародыша хкр, при котором ΔG достигает максимума:
 .
.
Работа образования этого зародыша вычисляется по формуле

Сравнение полученных формул для вычисления размера и работы образования двумерного критического зародыша с соответствующими выражениями для трехмерного зародыша (см. гл. 2.1) показывает, что критический размер двумерного зародыша в 2 раза меньше, чем трехмерного, меньше и работа образования критического двумерного зародыша. Вероятность образования в единице объема двумерного зародыша равна
 .
.


Рис. 2.13. Зависимость линейной скорости Рис. 2.14. Схема одновременного роста нескольких
роста кристалла от переохлаждения двумерных зародышей:
/—грань кристалла; 2— зародыши
Вероятность присоединения к зародышу в единицу времени хотя бы одного атома равна р2 = с2×ехр(—U/kT). Вероятность образования центра кристаллизации вычисляется по формуле
 ,
,
где с3 = с1×с2 — некоторая постоянная для данного вещества величина.
Скорость роста кристалла пропорциональна вероятности р, т. е.

Характер зависимости линейной скорости роста от переохлаждения Δ Т показан на рис. 2.13.
Величина интервала метастабильности при росте кристаллов Δ Т2 значительно меньше, чем Δ Т1 при зарождении. При этом, как правило, реализуется только восходящая ветвь кривой (см. рис. 2.13). Зависимость можно аппроксимировать следующей функцией:
 ,
,
где показатель степени 1 £ р £ 2. Двумерный зародыш быстро растет, последовательно присоединяя к своим боковым граням ряды атомов так, что слой, образованный зародышем, покрывает грань кристалла. После заполнения грани наступает пауза, длительность которой t ~ ехр(4s`хкp/kT) обратно пропорциональна вероятности р1. Затем наращивается новый слой и т. д. У кубического кристалла в идеальном случае все шесть граней перемещаются с одинаковой скоростью в направлениях своих нормалей.
Когда грань кристалла достаточно велика, длительность ее заполнения t значительно больше времени ожидания появления нового зародыша t. В этом случае возможны образование и независимый рост двух или нескольких зародышей (рис. 2.14).
2. На атомно-шероховатых поверхностях кристаллов могут надежно адсорбироваться отдельные атомы жидкости (рис. 2.10, б). При этом происходит так называемый нормальный рост кристаллов, когда атомы расплава беспорядочно присоединяются к любым точкам поверхности. В этом случае грань кристалла перемещается однородно по нормали к самой себе. Соответствующий расчет показывает, что линейная скорость роста в данном случае пропорциональна переохлаждению:
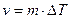 ,
,
где m = n×L×M×exp(—U/kT)/(T2nep×R); R — универсальная газовая постоянная; n — частота колебаний атомов в жидкости.
3. Механизм роста существенно изменяется, если на поверхности растущего кристалла имеются какие-нибудь выступы, которые облегчают закрепление частиц жидкости на поверхности кристалла. Очень часто такие выступы образуются в местах выхода винтовых дислокаций. Кристаллы, на гранях которых имеются ступеньки, возникшие в результате выхода винтовых дислокаций, растут послойно путем присоединения атомов расплава к этим ступенькам. Не приводя вывода, запишем формулу для вычисления линейной скорости в этом случае:
 ,
,
где s — межфазное натяжение на границе кристалл — жидкость; Vm — молярный объем жидкости; Д — коэффициент диффузии.
Из формулы видно, что линейная скорость роста v пропорциональна (ΔT)2. Дислокационный послойный рост происходит при значительно меньших переохлаждениях, чем рост двумерных зародышей. Интервал метастабильности по росту в этом случае равен нулю.
На рис. 2.15 приведены результаты исследования механизма роста в зависимости от величины переохлаждения на фронте кристаллизации. Видно, что при малых переохлаждениях рост осуществляется путем образования двумерных зародышей, при больших переохлаждениях

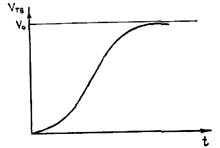
Рис. 2.15. Зависимость механизма роста кристаллов от Рис. 2.16. Кинетическая кривая криcталлизации
величины переохлаждения на фронте кристаллизации:
I — зона образования двумерных зародышей;
II — промежуточная зона;
III — зона нормального роста кристаллов
— по нормальному механизму. При этом фронт не огранен, т. е. имеет вид атомно-шероховатой поверхности. В промежуточной зоне переохлаждения рост может осуществляться по дислокационному механизму. В реальных условиях литья, как правило, реализуется нормальный механизм роста.
ГЛАВА 2.4. КИНЕТИКА КРИСТАЛЛИЗАЦИИ. ФОРМУЛА КОЛМОГОРОВА
Рассмотренные выше характеристики процесса кристаллизации—скорость возникновения центров кристаллизации п и линейная скорость роста кристаллов v — являются важнейшими кристаллизационными характеристиками, определяющими кинетику кристаллизации. Математической величиной, описывающей кинетику кристаллизации, является временная зависимость объема закристаллизовавшейся жидкости.
Решение задачи о кинетике нарастания твердой фазы при кристаллизации было впервые выполнено А. Н. Колмогоровым. Используя аппарат теории вероятности, можно получить следующую формулу:
 ,
,
где n(t) = v(т) — скорость возникновения центров кристаллизации и линейная скорость их роста как функции времени; V0 — начальный объем расплава. Формула справедлива для сферического зародыша. Если принять в ней n = const и v = const, то после интегрирования нетрудно получить формулу Колмогорова
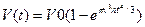 . (2.3)
. (2.3)
Графически она описывается кривой, показанной на рис. 2.16. Видно, что на начальных и конечных временных участках наблюдается незначительный темп нарастания твердой фазы. Замедление кристаллизации в конце объясняется тем, что растущие кристаллы начинают соприкасаться друг с другом при малом и непрерывно уменьшающемся количестве жидкости. Так как в конце кристаллизации объем жидкости мал, то основное положение вывода V0 >> Vкр не соблюдается. Поэтому из формулы вытекает неправдоподобный результат, что продолжительность полного затвердевания объема равна бесконечности. При этом погрешность формулы тем больше, чем меньше кристаллов и чем больше размер зерна. Принято считать, что формула обеспечивает расчет с погрешностью не более 1 %, если выполняется условие V0(n/v)3/4 > 200. Анализ показывает, что это условие, как правило, соблюдается при затвердевании реальных сплавов.
В обобщенном виде уравнение кинетики кристаллизации можно записать следующим образом:
 ,
,
где 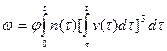 ; (j — коэффициент, учитывающий конфигурацию кристаллита (j = 4p/3 для шара и j = 8 для кубических кристаллитов).
; (j — коэффициент, учитывающий конфигурацию кристаллита (j = 4p/3 для шара и j = 8 для кубических кристаллитов).
Рассмотрим кинетику кристаллизации при объемном затвердевании. Возьмем некоторый объем сплава Vo, который охлаждается при малой интенсивности теплообмена с внешней средой. В этих условиях можно пренебречь перепадом температур по объему и рассматривать, что кристаллизация происходит путем равномерного выделения по всему объему твердой фазы. Такое затвердевание называют чисто объемным. Пусть при t = 0 температура расплава равна T = Tкр— Δ T1, где Δ T1 — интервал метастабильности по зарождению кристаллов. Напишем уравнение теплового баланса:
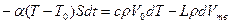 ,
,
где a — коэффициент теплоотдачи с наружной поверхности объема; S — поверхность охлаждения; T0 —температура среды; L, с и р — удельная теплота кристаллизации, теплоемкость и плотность расплава; Vтв — объем металла, затвердевшего за время t; dT— изменение температуры за время dt. Для оценки зависимости параметров п и v от переохлаждения примем v = m Δ T = m(Tкр – T), n = n0( Δ T – Δ T1)2 = n0(Tкp – T – Δ Tl)2 приΔ T >Δ T1 и n = 0, если Δ T £ Δ T1. Проинтегрируем это уравнение при начальном условии: при t = 0 Vтв = 0 и T = Tкр – Δ T1. Кроме того, в левой части уравнения примем T = Ткр ввиду малой величины переохлаждения Δ T при кристаллизации металлов.
 ,
,
Подставив в это уравнение выражение для Vтв (см. формулу Колмогорова), получаем интегральное уравнение, описывающее изменение температуры металла при его объемной кристаллизации:
 . (2.4)
. (2.4) 

Рис. 2.17. Изменение температуры расплава при его объемной кристаллизации
Решить это уравнение возможно только с применением численных методов на ЭВМ. Изменение температуры во времени показано на рис. 2.17 (расчетные данные). Подобный характер температурной кривой подтверждается многочисленными экспериментами.
Если бы в расплаве не выделялась теплота кристаллизации, то температура уменьшалась бы в соответствии со штриховой линией на рис. 2.17, которая отвечает уравнению T = Tкр – Δ T1 - (Ткр – Т0)×t×a /(c×r×R). Однако выделяющаяся теплота кристаллизации замедляет темп охлаждения, и в момент t = tmax dT/dt = 0, что соответствует минимуму температуры, или максимуму переохлаждения ( Δ T = Tкр – Т). При t > tmax dT/dt > 0, а температура сплава повышается, пока переохлаждение не станет меньше интервала метастабильности по зарождению Δ T1. При t > t1 Δ T < Δ Т1 и зарождение новых кристаллов в расплаве прекращается. Далее будет происходить только рост образовавшихся в период 0 < t < t1 центров до полного затвердевания металла при t = tзатв. Этот подъем температуры называется рекалесценцией.
Приближенное решение уравнения, выполненное с использованием метода итераций, позволило получить следующие формулы для расчета параметров температурной кривой:
 ;
;
 ;
;
 ;
;  ;
; 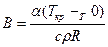 .
.
Для вычисления количества центров кристаллизации, зародившихся на первом этапе кристаллизации, получена следующая приближенная формула:
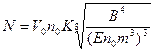 ,
,
где К» 3,5.
Расчеты на ЭВМ и эксперименты показали достаточную точность этих формул.
Величина N фактически определяет число кристаллических зерен в затвердевшей отливке, так как при t > t1 новые зерна не зарождаются. Приняв, что V0 = Npd3/6, где d — эффективный диаметр зерна, с учетом формулы для вычисления N легко найти следующее выражение для оценки величины кристаллического зерна при объемной кристаллизации:
 ,
,
где K1 = 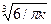 .
.
Из полученной формулы видно, что для измельчения зерна необходимо увеличить СВЦК. n0 и уменьшить линейную скорость роста т. Видно, что зерно измельчается при повышении коэффициента теплоотдачи а и снижении удельной теплоты кристаллизации L.
Рассмотренная выше схема чисто объемной кристаллизации, когда твердая фаза растет от отдельных центров во всем объеме жидкости, может быть реализована для чистых металлов при малом значении критерия Био (Bi = aR/l), т. е. при малых значениях a и R. При Bi > 0,l, как правило, объемная кристаллизация в центральных объемах сопровождается последовательным продвижением затвердевшей корки с поверхности охлаждения сплава к центру отливки. При объемной кристаллизации величина максимального переохлаждения Δ Tmах невелика (для алюминия не более 1—5°С, для железа — до 40 °С). Длительность первого этапа (t £ t1) составляет относительно небольшую долю от общего времени затвердевания. Как правило, мы измеряем термопарой температуру сплава на втором этапе затвердевания, когда переохлаждение (Δ T < Δ T1) очень мало. При этом температура, фиксируемая термопарой, близка к Ткр.
Изложенная теория показывает, какое большое значение для управления формированием кристаллического строения отливки кроме теплового режима имеет целенаправленное воздействие на кристаллизационные параметры п и v.
ГЛАВА 2.5. ПЕРЕРАСПРЕДЕЛЕНИЕ ПРИМЕСЕЙ НА ФРОНТЕ КРИСТАЛЛИЗАЦИИ СПЛАВОВ. ВНУТРИКРИСТАЛЛИЧЕСКАЯ ЛИКВАЦИЯ
При кристаллизации сплавов концентрации компонентов в фазах, находящихся в равновесии, как правило, различаются. Отношение концентраций компонента в находящихся в равновесии твердой и жидкой фазах k0 = CS/CL. называется равновесным коэффициентом распределения. На рис. 2.18, а приведен участок диаграммы состояния сплава, температура ликвидуса которого уменьшается с увеличением концентрации легирующего компонента В. Очевидно, что в этом случае коэффициент распределения k0 < 1 (обычно 0,2 £ k0 £ 0,6).
При повышении температуры ликвидуса (рис. 2.18, б) коэффициент распределения k0 > 1. Обычно в этом случае k0 < 3. Однако, например, в системе Ge — В k0 достигает 15.
Дальнейшее изучение кристаллизации будем проводить при k0 < 1, так как эта величина является характерной для большинства литейных сплавов.
Рассмотрим несколько частных случаев.
1. Скорость роста кристалла настолько мала, что диффузия успевает выравнять концентрации вещества по объему твердой и жидкой фаз. При этом концентрации будут соответствовать равновесным значениям, определенным для данной температуры по диаграмме состояния. На рис. 2.19 показано распределение концентрации по длине твердой и жидкой фаз. Ось ординат, которая

Рис. 2.18. Диаграммы состояния сплавов с понижением (а) и повышением (б) температуры ликвидуса в зависимости от роста концентрации легирующего компонента
соответствует концентрации, является подвижной и совпадает с положением фронта кристаллизации. В этом случае k0 = СS/СL.
2. Ситуация, более приближенная к реальной, имеет место, когда в твердой фазе при данной скорости роста кристалла не происходит диффузионного перераспределения вещества (Дтв = 0). Однако в жидкости, вследствие интенсивного перемешивания расплава, концентрации выравниваются. Так как Дтв = 0, то состав твердой фазы, образовавшийся на предыдущих стадиях, остается неизменным. Так как при k0 < 1 по мере кристаллизации CS увеличивается (см. рис. 2.18, а), то концентрация вещества будет возрастать по длине твердой фазы, оставаясь на фронте кристаллизации равной соответствующему значению, определенному по диаграмме состояния. Распределение концентраций по длине фаз в рассматриваемом случае приведено на рис. 2.20. Так как концентрация жидкости cl больше концентрации твердой фазы на фронте кристаллизации CS, то при затвердевании жидкости на фронте кристаллизации выделяется легирующий компонент. Например, если за время dt затвердевает dm жидкости, то количество выделившегося вещества равно (Cl—CS)dm. В данном случае это вещество равномерно распределяется по объему жидкости.
Явление, связанное с неравномерным распределением концентрации вещества, называется ликвацией. В рассматриваемом случае наблюдается максимальная ликвация в твердой фазе, называемая внутрикристаллической ликвацией. При этом внутренние слои сферического


Рис. 2.19. Распределение концентрации по длине Рис. 2.20. Распределение концентраций по
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 377; Нарушение авторских прав?; Мы поможем в написании вашей работы!