
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение оснований
|
|
|
|
Свойства оснований
Типичные основания взаимодействуют с кислотами и с кислотными оксидами с образованием солей и воды:
Mg(OH)2 + 2HCl = MgCl2 + 2H2O; Ca(OH)2 + CO2 = CaCO3 + H2O
Взаимодействие щелочей с кислотами называется реакцией нейтрализации. В реакции нейтрализации Н+-катионы кислот и ОН–-анионы щелочей соединяются в молекулы воды, поэтому среда раствора с химической точки зрения становится нейтральной. Типичный пример реакции нейтрализации:
NaOH + HCl = NaCl + H2O – молекулярное уравнение;
H+ + OH– = H2O – ионное уравнение.
Гидрат аммиака взаимодействует с кислотами с образованием солей аммония и воды:
NH3∙H2О + HCl = NH4Cl + H2O
Щелочи и гидрат аммиака взаимодействуют с растворами солей с образованием нерастворимых оснований:
2NaOH + CuSO4 = Cu(OH)2¯ + Na2SO4
6NH3∙H2О + 2Al2(SO4)3 = 2Al(OH)3¯ + 3(NH4)2SO4
Амфотерные основания взаимодействуют как с кислотами, так и со щелочами. В реакциях с кислотами они проявляют свойства типичных оснований:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Но при взаимодействии со щелочами амфотерные основания проявляют свойства кислот. При сплавлении со щелочами образуются обычные соли (оксосоли) и вода:
Al(OH)3 + NaOH(расплав) = NaAlO2 + 2H2O,
а при взаимодействии с растворами щелочей – комплексные соли (гидроксосоли):
Al(OH)3 + 3NaOH(раствор) = Na3[Al(OH)6]
Для получения оснований используются различные способы.
1. Нерастворимые неамфотерные основания получают взаимодействием щелочей с растворами солей:
MnSO4 + 2Na(OH) = Mn(OH)2¯ + Na2SO4
Но если получаемое этим способом основание является амфотерным, оно взаимодействует с избытком щёлочи. Поэтому при получении амфотерных оснований вместо щелочей используют раствор аммиака:
|
|
|
AlCl3 + 3NH3∙H2О = Al(OH)3¯ + 3NH4Cl
2. Нерастворимые основания получают также с помощью солей, которые в водных растворах дают щелочную среду вследствие гидролиза. Одной из таких солей является карбонат натрия:
Al2(SO4)3 + 3Na2CO3 + 3H2O = Al(OH)3¯ + 3Na2SO4 + 3CO2
3. Щелочи получают взаимодействием щелочных металлов или их оксидов с водой:
2К + 2H2O = 2КOH + H2; ВaO + H2O = Вa(OH)2
Самыми распространенными основаниями являются щелочи NaOH и Ca(OH)2, которые получают в больших количествах.
Гидроксид натрия получают электролизом водного раствора хлорида натрия:
2NaCl + 2H2O 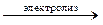 2NaOH + H2↑ + Cl2↑
2NaOH + H2↑ + Cl2↑
Гидроксид кальция получают взаимодействием с водой оксида кальция, получаемого разложением природного соединения – карбоната кальция:
CaСO3 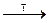 CaO + СО2↑; CaO + H2O = Ca(OH)2
CaO + СО2↑; CaO + H2O = Ca(OH)2
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 767; Нарушение авторских прав?; Мы поможем в написании вашей работы!