
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнения окислительно-восстановительных реакций
|
|
|
|
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно подразделяются на четыре типа: межмолекулярные, внутримолекулярные, диспропорционирование и конпропорционирование.
В межмолекулярных окислительно-восстановительных реакциях окислитель и восстановитель – различные вещества. Например, в реакции
4NH3 + 3O2 = 2N2 + 6H2O
окислителем является кислород O2, а восстановителем аммиак NH3, а в реакции
5K2SO3 + 2KMnO4 + 3H2SO4 = 6K2SO4 + 2MnSO4 + 3H2O
окислитель – перманганат калия KMnO4, а восстановителем – сульфит калия K2SO3.
Внутримолекулярные окислительно-восстановительные реакции отличаются тем, что элементы окислитель и восстановитель (разные элементы) содержатся в составе одного и того же соединения. Например, в реакции
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
восстановителем являются атомы азота, а окислителем атомы хрома в составе разлагающегося дихромата аммония (NH4)2Cr2O7.
Диспропорционирование (или дисмутация) отличается тем, что окисляются и восстанавливаются атомы одного и того же элемента. Например, в реакции
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
окисляются и восстанавливаются атомы хлора.
Реакции конпропорционирования – это реакции, обратные реакциям диспропорционирования. В таких реакциях атомы одного и того же элемента (в разных соединениях и в различных степенях окисления) окисляют и восстанавливают друг друга; обычно продуктом этих реакций является простое вещество, в котором этот элемент имеет нулевую степень окисления:
5HI + HIO3 = 3I2 + 3H2O
Пример 8. Определите тип каждой из данных окислительно-восстановительных реакций:
1) KI + HNO3 → KIO3 + NO2 + H2O 2) KClO4 → KCl + O2
3) K2SO3 → K2SO4 + K2S 4) H2S + SO2 → S + H2O
|
|
|
Решение. Запишем схемы реакций с указанием степени окисления тех элементов у которых она изменяется:
1) K 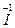 + H
+ H  O3
O3 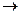 K
K 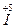 O3 +
O3 + 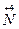 O2 + H2O; 2) K
O2 + H2O; 2) K 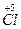
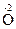 3
3 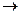 K
K 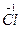 +
+ 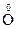 2
2
3) K2 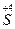 O3
O3  K2
K2 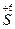 O4 + K2
O4 + K2 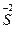 ; 4) H2
; 4) H2 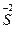 +
+ 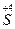 O2
O2 
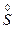 + H2O;
+ H2O;
В первой реакции восстановитель (KI) и окислитель (HNO3) – разные вещества, следовательно, эта реакция межмолекулярная.
Во второй реакции окислитель (хлор) и восстановитель (кислород) находятся в составе одного вещества (KClO3), поэтому данная реакция внутримолекулярная.
В третьей реакции окисляется и восстанавливается один и тот же элемент – сера в составе K2SO3, поэтому в данной реакции происходит диспропорционирование серы.
В последней реакции окисляется и восстанавливается один и тот же элемент сера в составе H2S и SO2, поэтому данная реакция – реакция конпропорционирования.
Определение коэффициентов перед формулами веществ (стехиометрических коэффициентов) в уравнениях окислительно-восстановительных реакций проводят двумя методами: электронного баланса и полуреакций. Студенты нехимических специальностей изучают только метод электронного баланса.
По методу электронного баланса сначала находят окислитель, восстановитель и элементы, у которых изменяется степень окисления, например:
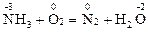
вос ок
После этого записывают электронные схемы отдачи электронов восстановителем и их присоединения окислителем:
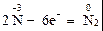 2
2
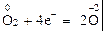 3
3
Цифры справа от вертикальной черты показывают, какими должны быть наименьшие числа атомов восстановителя и окислителя, чтобы число отданных и присоединенных электронов было одинаковым. Они являются стехиометрическими коэффициентами в уравнении реакции:
4NH3 + 3O2 = 2N2 + 6H2O
Метод электронного баланса не согласуется с современными данными, полученными при исследовании механизма реакций. В большинстве окислительно-восстановительных реакций перехода электронов от атома к атому не происходит, а причиной изменения степени окисления элементов является изменение состава и строения веществ. Поэтому электронные схемы в методе электронного баланса не отражают реального механизма окислительно-восстановительных реакций. Но подбирать стехиометрические коэффициенты этим методом можно, если схема реакции дана полностью, если известны исходные вещества и продукты реакции.
|
|
|
Пример 9. Покажите, что стехиометрические коэффициенты в уравнениях реакций, которые приведены в п. 5. (Классификация окислительно-восстановительных реакций) определены правильно.
Решение. В п. 5. приведены уравнения пяти реакций; покажем электронные схемы окисления и восстановления для первых четырёх реакций
1) 4NH3 + 3O2 = 2N2 + 6H2O
 2
2 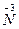 – 6e =
– 6e = 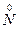 2 2
2 2
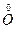 2 + 4e = 2
2 + 4e = 2 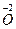 3
3
2) 5K2SO3 + 2K2MnO4 + 3H2SO4 = 5K2SO4 + 2MnSO3 + 3H2O

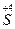 – 2e =
– 2e = 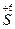 5
5
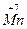 + 5e =
+ 5e = 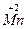 2
2
3) (NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
 2
2 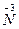 – 6e =
– 6e = 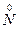 2 1
2 1
2 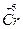 + 6e = 2
+ 6e = 2 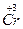 1
1
4) 3Cr2 + 6KOH = 5KCl + KClO3 + 3H2O

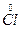 2 – 10e = 2
2 – 10e = 2 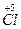 1
1
Cl2 + 2e = 2 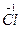 5
5
Схемы электронного баланса свидетельствуют о том, что коэффициенты в уравнениях реакций определены правильно.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1873; Нарушение авторских прав?; Мы поможем в написании вашей работы!