
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантовые числа
|
|
|
|
Характеристики электронов и атомных орбиталей определяется четырьмя квантовыми числами: главным, орбитальным, магнитным и спиновым.
Главное квантовое число (n) имеет значения натурального ряда чисел (1, 2, 3,…). Оно определяет энергию электрона в атоме. Состояние электронов в атоме с тем или иным значением главного квантового числа называется энергетическим уровнем.
Например, если электрон характеризуется главным квантовым числом n = 1, он находится на первом энергетическом уровне, если n = 2, то на втором и т.д.
Состояние атома с наименьшей энергией электронов называется нормальным (основным), а остальные, с более высокими уровнями энергии – возбужденными. Переходы между основным состоянием и возбужденными проявляются в линейчатых спектрах атомов (рис. 3). Эти переходы квантовая механика объясняет скачкообразными изменениями размеров атомных орбиталей. Из этого следует, что главное квантовое число определяет не только энергию электрона, но и его размеры.
Орбитальное квантовое число (l) определяет распределение электронного облака в околоядерном пространстве, т.е. форму атомной орбитали. Значения l зависят от главного квантового числа: l = 0, 1, 2,… (n– 1). Каждому значению орбитального квантового числа соответствует определённое символическое (буквенное) обозначение и форма атомной орбитали. Установлено, что в наиболее сложных атомах могут быть четыре вида атомных орбиталей, которые обозначаются буквами s(l = 0), p(l = 1), d(l = 2) и f(l = 3).
При n = 1 орбитальное квантовое число может иметь лишь одно значение: l = 0. При n = 2 орбитальное квантовое число имеет два значения (l = 0 и l = 1), при n = 3 – три значения (0, 1 и 2), на четвёртом – четыре (0, 1, 2 и 3). Иначе говоря, на первом энергетическом уровне (n = 1) электрон имеет лишь одну форму орбитали (s), на втором – две (s, p), на третьем – три (s, p, d), на четвёртом – четыре (s, p, d и f) Таким образом, начиная со второго, энергетические уровни многоэлектронного атома «расщепляются» на подуровни.
|
|
|
Наличие энергетических подуровней подтверждается тем, что в спектрах сложных атомов каждая линия представляет набор двух, трех и более близко расположенных линий (рис. 4). Но в одноэлектронных частицах (H, He+, Li2+ и т.п.) энергия подуровней одинакова; в квантовой механике говорят, что в этом случае подуровни вырождены.
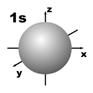
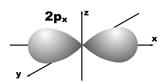
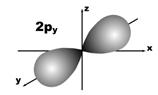
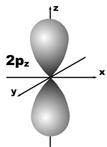
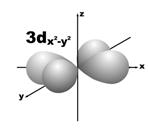
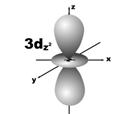
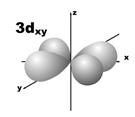
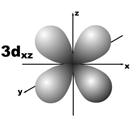
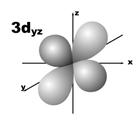
Магнитное квантовое число (ml) определяет ориентацию атомных орбиталей в пространстве. Оно имеет значения от – l до + l, а всего 2 l + 1 значений. Так, при l = 0 магнитное квантовое число имеет одно значение, равное нулю, при l = 1 – три значения (–1, 0, +1),при l = 2 – пять значений (–2, –1, 0, +1, +2). Это означает, что для s-орбитали (ml = 0) ориентация в пространстве не имеет значения, поскольку её сферическая форма обладает абсолютной симметрией; p-орбиталь может быть ориентирована тремя способами, d-орбиталь имеет пять возможных ориентаций в пространстве, а f-орбиталь (для которой магнитное квантовое число имеет семь значений от –3 до +3) – семь. На рис. 5 дано изображение атомных орбиталей с учетом их ориентации в пространстве и их обозначение.
| |||
| 
| 
| |
| 
| ||
| 
| 
| |
Рис. 5. Форма и ориентация атомных орбиталей в пространстве
В отсутствии внешних полей энергия орбитали не зависит от её ориентации. Но под влиянием электрического или магнитного полей энергия орбиталей одного и того же подуровня становится разной, и поэтому в спектрах, снятых в магнитном или электрическом полях, происходит дополнительное расщепление линий (эффект Штарка – Зеемана).
Следует знать, что атом или ион создаёт вблизи себя электрическое поле, намного более сильное, чем поля, создаваемые в технике, поэтому при сближении атомов на близкие расстояния, например при вступлении их в химическую связь, ориентация орбиталей имеет большое значение.
|
|
|
Спиновое квантовое число (ms)характеризует собственный магнитный момент электрона, который или совпадает с ориентацией орбитального момента, или направлен в противоположную сторону. В связи с этим ms имеет только два значения: +1/2 или –1/2.
В тех случаях, когда форма и ориентация орбиталей не имеют значения, их изображают квадратиком, а электроны – стрелочками внутри них. Электроны с противоположными значениями спина обозначаются стрелками противоположных направлений (рис. 6).
1)  2)
2)  3)
3) 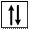
Рис. 6. Схематическое изображение атомной орбитали без электронов (1),
с одним (2) и двумя (3) электронами
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 856; Нарушение авторских прав?; Мы поможем в написании вашей работы!