
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронные формулы и электронно-графические схемы
|
|
|
|
Электронное строение атома можно показать электронной формулой и электронно-графической схемой. В электронных формулах последовательно записываются энергетические уровни и подуровни в порядке их заполнения и общее число электронов на подуровне. При этом состояние отдельного электрона, в частности его магнитное и спиновое квантовые числа, в электронной формуле не отражено. В электронно-графических схемах каждый электрон «виден» полностью, т.е. его можно охарактеризовать всеми четырьмя квантовыми числами. Электронно-графические схемы обычно приводятся для внешних электронов.
Пример 1. Напишите электронную формулу фтора, состояние внешних электронов выразите электронно-графической схемой. Сколько неспаренных электронов в атоме этого элемента?
Решение. Атомный номер фтора равен девяти, следовательно, в его атоме имеется девять электронов. В соответствии с принципом наименьшей энергии, пользуясь рис. 7 и учитывая следствия принципа Паули, записываем электронную формулу фтора: 1s22s22p5. Для внешних электронов (второй энергетический уровень) составляем электронно-графическую схему (рис. 8), из которой следует, что в атоме фтора имеется один неспаренный электрон.

Рис. 8. Электронно-графическая схема валентных электронов атома фтора
Пример 2. Составьте электронно-графические схемы возможных состояний атома азота. Какие из них отражают нормальное состояние, а какие – возбужденное?
Решение. Электронная формула азота 1s2s22p3, формула внешних электронов: 2s22p3. Подуровень 2p незавершен, т.к. число электронов на нем меньше шести. Возможные варианты распределения трех электронов на 2р-подуровне показаны на рис. 9.
|
|
|
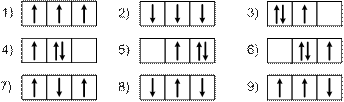
Рис. 9. Электронно-графические схемы возможных состояний 2р-подуровня в атоме азота.
Максимальное (по абсолютной величине) значение спина (3/2) соответствует состояниям 1 и 2, следовательно, они являются основными, а остальные – возбужденные.
Пример 3. Определите квантовые числа, которыми определяется состояние последнего электрона в атоме ванадия?
Решение. Атомный номер ванадия Z = 23, следовательно, полная электронная формула элемента: 1s22s22p63s23p64s23d3. Электронно-графическая схема внешних электронов (4s23d3) такова (рис. 10),:

Рис. 10. Электронно-графическая схема валентных электронов атома ванадия
Главное квантовое число последнего электрона n = 3 (третий энергетический уровень), орбитальное l = 2 (подуровень d). Mагнитное квантовое число для каждого из трех d-электронов различно: для первого оно равно –2, для второго –1, для третьего – 0. Спиновое квантовое число у всех трех электронов одинаково: ms = +1/2. Таким образом, состояние последнего электрона в атоме ванадия характеризуется квантовыми числами: n = 3; l = 2; m = 0; ms = +1/2.
7. Спаренные и неспаренные электроны
Электроны, заполняющие орбитали попарно, называются спаренными, а одиночные электроны называются неспаренными. Неспаренные электроны обеспечивают химическую связь атома с другими атомами. Наличие неспаренных электронов устанавливается экспериментально изучением магнитных свойств. Вещества с неспаренными электронами парамагнитны (втягиваются в магнитное поле благодаря взаимодействию спинов электронов, как элементарных магнитов, с внешним магнитным полем). Вещества, имеющие только спаренные электроны, диамагнитны (внешнее магнитное поле на них не действует). Неспаренные электроны находятся только на внешнем энергетическом уровне атома и их число можно определить по его электронно-графической схеме.
|
|
|
Пример 4. Определите число неспаренных электронов в атоме серы.
Решение. Атомный номер серы Z = 16, следовательно, полная электронная формула элемента: 1s22s22p63s23p4. Электронно-графическая схема внешних электронов такова (рис. 11).
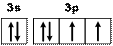
Рис. 11. Электронно-графическая схема валентных электронов атома серы
Из электронно-графической схемы следует, что в атоме серы имеется два неспаренных электрона.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 9893; Нарушение авторских прав?; Мы поможем в написании вашей работы!