
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электроотрицательность
|
|
|
|
Электроотрицательностью называется свойство химического элемента притягивать к своему атому электроны от атомов других элементов, с которыми данный элемент образует химическую связь в соединениях.
При образовании химической связи между атомами разных элементов общее электронное облако смещается к более электроотрицательному атому, из-за чего связь становится коваленто-полярной, а при большой разности электроотрицательностей – ионной.
Электроотрицательность определяли Полинг, Малликен и другими ученые. Полинг выразил электроотрицательность в условных относительных единицах; по такому же пути пошли Олред и Рохов, которые предлагают более точные, чем Полинг, значения электроотрицательности. В справочнике имеются их данные. Видно, что наибольшие значения электроотрицательности имеют неметаллы (фтор, хлор, кислород, азот), а наименьшие – щелочные металлы (литий, натрий). В таблице отсутствуют данные об электроотрицательности последних элементов периодов – гелия, неона и аргона, т.к. эти элементы не образуют соединений.
Электроотрицательность является периодическим свойством: в периодах она увеличивается, а в группах уменьшается (рис. 15).
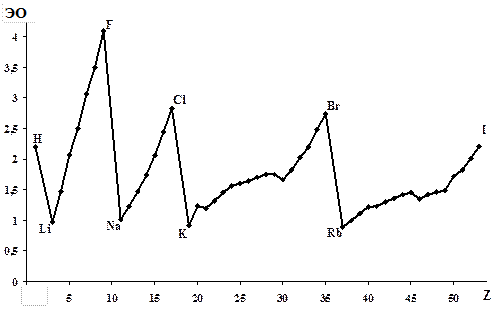
Рис 15. Зависимость электроотрицательности от атомного номера
для элементов первого–пятого периодов.
Пример 11. Исходя из электроотрицательности элементов, установите правильное написание формул водородных соединений p-элементов пятой группы.
Решение. Электроотрицательность водорода и p-элементов пятой группы по Полингу равна: водород – 2,1, азот – 3,0, фосфор – 2,1, мышьяк – 2,0,сурьма – 1,9, висмут – 1,9. В формулах бинарных соединений символ менее электроотрицательного элемента записывается первым, а более электроотрицательного – вторым. Следовательно, правильная запись формулы аммиака H3N, но химики пользуются исторически сложившейся формулой NH3. У соединений мышьяка, сурьмы и висмута с водородом формулы очевидны: AsH3, SbH3, BiH3. Фосфор имеет такую же электроотрицательность, что и водород, поэтому формулу соединения можно записывать как РН3, так и Н3Р; обычно пользуются первой записью.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1168; Нарушение авторских прав?; Мы поможем в написании вашей работы!