
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Валентность в методе ВС
|
|
|
|
Насыщаемость и направленность ковалентной связи
Гейтлер и Лондон провели расчет энергии взаимодействия молекулы водорода с третьим атомом водорода (Н2 + Н = Н3). Расчет показал, что образование молекулы Н3 невозможно. Невозможность присоединения третьего атома водорода к молекуле Н2 объясняется тем, что спин третьего атома неизбежно будет совпадать по значению (направлению) со спином одного из атомов в молекуле, что невозможно в соответствии с принципом Паули. Таким образом, ковалентная связь насыщаема. Насыщаемость ковалентной связи определяет состав молекул.
Другим свойством ковалентной связи является ее направленность. Это свойство ковалентной связи объясняется тем, что в первую очередь между атомами образуется наиболее прочная s-связь, которая возникает в результате перекрывания орбиталей вдоль прямой линии, соединяющей ядра взаимодействующих атомов. Это придает ковалентной связи определенную направленность. От этого зависит геометрическое строение молекул, которое будет рассмотрено в конце этой лекции.
Согласно методу ВС, для образования химической связи по обменному механизму каждый атом затрачивает один неспаренный электрон. Следовательно, валентность химического элемента определяется числом неспаренных электронов в его атоме в нормальном или возбужденном состоянии.
В атоме водорода имеется один неспаренный электрон, поэтому он всегда одновалентен.
В атоме гелия в нормальном состоянии нет неспаренных электронов: его оба электрона находятся на орбитали 1s в спаренном состоянии (1s2). Возбуждение же атома с переходом электрона на следующий энергетический уровень требует большой затраты энергии. Для атома гелия энергия возбуждения электрона из состояния 1s на орбиталь 2s равна 1672 кДж/моль. Такие высокие энергии возбуждения при химических реакциях не наблюдаются. Поэтому гелий не образует соединений, его валентность равна нулю.
|
|
|
Атом лития в нормальном состоянии имеет один неспаренный электрон:1s22s1. Распаривание двух электронов, находящихся на первом энергетическом уровне, с переходом одного из них на второй энергетический уровень (на свободную 2р-орбиталь) требует большой энергии. Поэтому литий одновалентен.
Для бериллия перевод его в возбужденное состояние (Ве*) по схеме (рис. 11) требует сравнительно небольшой энергии (259 кДж/моль), поэтому в возбужденном состоянии у атома бериллия два неспаренных электрона, благодаря которым он двухвалентен.

Рис. 11. Схема возбуждения атомов бериллия
Атом бора в нормальном состоянии ([He]2s22p1) имеет один неспаренный электрон, но при возбуждении их число увеличивается до трёх (рис. 12), поэтому бор трехвалентен.
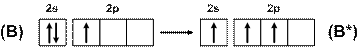
Рис. 12. Схема возбуждения атомов бора
У атома углерода в нормальном состоянии имеется два неспаренных электрона, поэтому в некоторых соединениях он двухвалентен. Но для углерода более характерна валентность четыре. Четырехвалентное состояния объясняется возбуждении атомов (рис. 13):

Рис. 13. Схема возбуждения атомов углерода
У атома азота имеется три неспаренных электрона: 2s22p3. На втором энергетическом уровне свободных орбиталей нет, поэтому расспаривание электронов, находящихся на 2s-орбитали, невозможно. Следовательно, с позиций метода ВС валентность азота не может быть больше трех. Действительно, азот с одновалентными элементами водородом и фтором образует NH3 и NF3 и не образует NH5 и NF5. Но максимальная стехиометрическая валентность азота может быть равна пяти (N2O5, HNO3, NaNO3 и т.п.). Здесь имеет место расхождение между стехиометрической валентностью и числом двухэлектронных связей.
|
|
|
В атоме кислорода два неспаренных электрона (2s22p4), на втором энергетическом уровне свободных орбиталей нет, поэтому расспаривание спаренных электронов невозможно. Поэтому кислород, согласно методу ВС, двухвалентен, несмотря на то, что в его атоме имеется формально шесть валентных электронов.
В атоме фтора имеется один неспаренный электрон (2s22p5), расспаривание спаренных электронов из-за отсутствия свободных орбиталей невозможно, поэтому фтор одновалентен, хотя его атом имеет семь валентных электронов.
Электронное строение атома последнего элемента второго периода неона таково (2s22p6), что в нем нет неспаренных электронов. Поэтому неон, подобно гелию, не образует соединений; его валентность равна нулю.
У элементов третьего периода валентные электроны в атомах располагаются на третьем энергетическом уровне, на котором имеется свободный 3d-подуровень. За счет этого появляются дополнительные возможности для расспаривания электронов и увеличения валентности элементов.
Так, например, фосфор, в отличие от азота, может иметь пять неспаренных электронов благодаря возбуждению по схеме (рис. 14), что объясняет существование молекул не только РН3, PF3, PCl3, но и РF5, PCl5 и т.п.
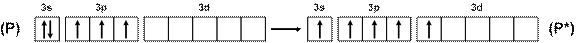
Рис. 14. Схема возбуждения атомов фосфора
У серы возможны два варианта возбуждения атома (рис. 15), поэтому сера, кроме двухвалентного состояния (Н2S), может быть четырехвалентной (SO2) и шестивалентной (SO3, H2SO4, SF6 и т.п.).
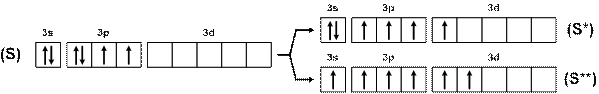
Рис. 15. Схема возбуждения атомов серы
Хлор, кроме одновалентного состояния (HCl, Cl2O), обусловленного одним неспаренным электроном в невозбужденном атоме, проявляет валентность три (СlF3, Cl2O3, HClO2), пять (ClF5, HClO3) и семь (ClF7, HClО4, Cl2O7). Объяснение этому факту – три варианта возбуждения с переходом валентных электронов на свободные орбитали 3d-подуровня (рис. 16):
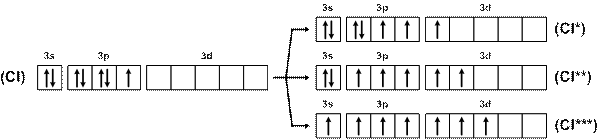
Рис. 16. Схема возбуждения атомов хлора
Таким образом, объяснение валентности элементов числом неспаренных электронов в атомах в общем согласуется со стехиометрической валентностью, но имеется немало исключений, когда стехиометрическая валентность элемента не равна числу неспаренных электронов в атоме. Например, в пероксиде водорода стехиометрическая валентность кислорода равна единице, хотя атомы кислорода имеют по два неспаренных электрона. Поэтому валентность элементов, обусловленную наличием неспаренных электронов в атомах в нормальном и возбужденном состояниях, называют, в отличие от стехиометрической валентности, ковалентностью.
|
|
|
Пример 3. Определите ковалентность и стехиометрическую валентность азота в молекулярном азоте N2 и кислорода в пероксиде водорода H2O2.
Решение. 1) В молекуле N2 в химической связи участвуют по три неспаренных электрона от каждого атома, связь обусловлена тремя общими электронными парами: N ::: N (рис. 5). Следовательно, ковалентность азота равна трем. Но стехиометрическая валентность, которая показывает, со сколькими атомами другого одновалентного элемента соединяется атом данного элемента, равна нулю.
2) В молекуле H2O2 кислород использует в образовании связи два имеющихся в его атоме неспаренных электрона; один неспаренный электрон участвует в связи с атомом водорода, а другой – с атомом кислорода:
Н: О: О: Н или Н—О—О—Н
Следовательно, ковалентность кислорода равна двум, но стехиометрическая валентность – единице, так как связи атомов одного элемента друг с другом в стехиометрической валентности не учитываются.
Пример 4. Объясните образование химической связи в молекуле оксида углерода СО, определить ковалентность и электронную валентность углерода в этом соединении.
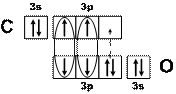
Решение. У атомов углерода и кислорода имеется по два неспаренных электрона. Можно предполагать, что между этими атомами возникает двойная связь по обменному механизму. Но оксид углерода СО представляет собой очень прочную молекулу с энергией связи большей (1075 кДж/моль), чем в молекуле азота (945 кДж/моль), в которой атомы азота связаны тройной связью. Поэтому химическая связь в молекуле СО считается тройной: две общие электронные пары образуются по обменному, а третья – по донорно-акцепторному механизму. Донором электронной пары при этом является атом кислорода, а акцептором – углерода. Схема образования связей в этой молекуле приведена на рисунке (рис. 17), на котором образование общих электронных пар по обменному механизму показано сплошными линиями, а по донорно-акцепторному – пунктирной стрелкой, направленной от пары электронов донора к свободной орбитали акцептора.
|
|
|
 или
или 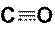
Рис. 17. Схема химической связи в молекуле СО
 – связи, образующиеся по обменному механизму
– связи, образующиеся по обменному механизму
 – связь, образующаяся по донорно-акцепторному механизму
– связь, образующаяся по донорно-акцепторному механизму
Таким образом, оксид углерода СО представляет собой химическое соединение, в котором стехиометрическая валентность (два) и ковалентность (два) обоих атомов меньше числа образующихся между ними связей (три).
Многие неорганические соединения, подобно оксиду углерода СО, сочетают в себе обменный и донорно-акцепторный механизмы химической связи, причем, связи, образованные по донорно-акцепторному механизму, не отличаются ни длиной, ни энергией от связей, образованных по обменному механизму. Поэтому ковалентность является неполной характеристикой валентных возможностей элемента. Целесообразно использовать для этой цели понятие электронная ( или связевая ) валентность, которое учитывает связи, образующиеся как по обменному, так и по донорно-акцепторному механизму. В настоящее время аналогом этого понятия является термин число связ ей, который неудачен. Например, говорят, что в оксиде углерода СО число связей равно трём. Но в действительности это не так: связь между атомами одна, а три – её кратность и электронная валентность углерода.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 2525; Нарушение авторских прав?; Мы поможем в написании вашей работы!