
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стандартная энергия Гиббса образования вещества
|
|
|
|
Стандартной энергией Гиббса образования вещества (DfGo) называется изменение энергии Гиббса реакции образования одного моля вещества из простых веществ при стандартных условиях. Значения DfGo приводятся в таблицах термодинамических свойств веществ. Они используются для расчета энергии Гиббса реакций, протекающих при стандартных условиях по соотношению:
DGo298 = S(DfGoпрод)∙n – S(DfGoреаг) n
По стандартным энергиям Гиббса образования химических соединений судят об их устойчивости. Если DfGo < 0, то вещество может быть получено из простых веществ, а его разложение на простые вещества невозможно, такие вещества называются термодинамически устойчивыми. Если же DfGo > 0, то получение из простых веществ невозможно, и наоборот, должно идти разложение сложного вещества на простые. Такие вещества получают из других сложных веществ («косвенным путем») и они являются термодинамически неустойчивыми.
ЛЕКЦИЯ 7
Тема 8. Основы химической кинетики
По этой теме необходимо знать и уметь следующее.
1.(66). Объяснять предмет химической кинетики и его отличие от химической термодинамики.
2.(67). Знать принципы классификации реакций на гомогенные и гетерогенные; простые и сложные; последовательные, параллельные и цепные; моно-, би- и тримолекулярные; приводить примеры соответствующих реакций.
3.(68). Знать закон действующих масс для скорости реакций, записывать кинетические уравнения реакций; для сложных реакций различать кинетический порядок и молекулярность реакции.
4.(69). Устанавливать кинетический порядок реакции по зависимости её скорости от концентрации реагентов, вычислять константу скорости реакции по данным о зависимости её скорости от концентрации реагентов.
|
|
|
5.(70). Объяснять физический смысл энергии активации и причину увеличения скорости реакции при повышении температуры; знать правило Вант-Гоффа и уравнение Аррениуса, проводить по ним прямые и обратные расчёты.
6.(71). Объяснять сущность катализа, приводить примеры каталитических реакций, вычислять увеличение скорости или константы скорости реакции при использовании катализаторов (при известных значениях энергии активации реакции без катализатора и при использовании катализатора).
Содержание лекции.
1. Предмет химической кинетики
2. Классификация реакций в химической кинетике
3. Скорость реакции
4. Закон действующих масс
5. Определение кинетического порядка реакции
6. Кинетические уравнения гетерогенных реакций
7. Влияние температуры на скорость реакций
7.1. Уравнение Аррениуса
7.2. Теория переходного состояния
7.3. Температурный коэффициент скорости реакции
8. Катализ и сорбция
9. Тест для самоконтроля
10. Задания для самостоятельной работы
1. Предмет химической кинетики
Не каждая термодинамически возможная реакция, для которой энергия Гиббса отрицательна, протекает в действительности. Скорости некоторых реакций так малы, что практически их невозможно заметить. Другие реакции, наоборот, проходят с огромными скоростями. Управление скоростями реакций, умение замедлять или ускорять их имеет огромное значение.
Химической кинетикой называется наука (часть химии), которая изучает скорость и механизмы химических реакций.
Химическую кинетику от химической термодинамики отличает следующее. Термодинамика – наука о макросистемах. Отдельные частицы (молекулы, атомы, электроны и т.д.) или небольшое их число не являются предметом ее изучения. Термодинамику не интересуют механизмы процессов, она изучает изменения систем, рассматривая лишь их начальное и конечное состояния. Химическая кинетика, напротив, изучает ход реакций во времени и рассматривает их механизм на уровне отдельных частиц. Таким образом, химическая кинетика и химическая термодинамика, дополняя одна другую, дают целостное представление о закономерностях протекания реакций.
|
|
|
2. Классификация реакций в химической кинетике
В химической кинетике применяются две классификации химических реакций: первая – по фазовому составу реагентов, вторая – по степени сложности.
По первой классификации реакции подразделяются на: 1) гомогенные, которые протекают по всему объему реагирующих веществ (например, взаимодействия газообразных, жидких или растворенных веществ) и 2) гетерогенные, которые протекают на границе фаз (например, реакция металла с кислотой). По второй классификации реакции подразделяются на простые и сложные.
Простой (элементарной) называется реакция, в которой превращение исходных веществ в продукты осуществляется без образования промежуточных веществ, т. е. в одну стадию.
По числу молекул (или ионов в растворах электролитов), одновременно участвующих в химическом превращении, простые реакции подразделяются на мономолекулярные, бимолекулярные и тримолекулярные.
В мономолекулярныхреакциях в превращении реагента в продукт участвует одна молекула – это реакции разложения сложных веществ на менее сложные или простые вещества, а также молекул на простых веществ на атомы, например:
N2O4 = 2NO2; C2H5OH = C2H4 + H2O; Cl2 = 2Cl
В бимолекулярных реакциях превращение реагентов в продукты осуществляется при соударении двух молекул:
2HI = H2 + I2; NO + H2O = NO2 + N2,
а в тримолекулярных – трех:
2NO + H2 = N2O + H2O; 2NO + Cl2 = 2NOCl.
Вероятность столкновения более двух молекул очень мала, поэтому тримолекулярных реакций немного, а четырехмолекулярные вообще неизвестны.
Сложные реакции (они составляют огромное большинство реакций) подразделяются на последовательные, параллельные и цепные.
В последовательных реакциях продукты предыдущих стадий расходуются в последующих. Примером таких реакций является разложение оксида азота (V), описываемое уравнением:
2N2O5 = 4NO2 + O2
Может показаться, что эта реакция относится к простым бимолекулярным, т.к. перед реагентом стоит коэффициент 2. В действительности эта реакция проходит в две стадии:
|
|
|
1) N2O5 = N2O3 + O2, 2) N2O3 + N2O5 = 4NO2,
причем, первая стадия – мономолекулярная, а вторая – бимолекулярная.
Параллельными называются реакции, имеющие одни и те же реагенты, но различные продукты реакции. Например, термическое разложение хлората калия может одновременно протекать по двум направлениям:
а) диспропорционирование: 4KClO3 = 3KClO4 + KCl;
б) внутримолекулярное окисление – восстановление: 2KClO3 = 2KCl + 3O2.
Цепными называются реакции, в которых возникают промежуточные активные частицы, вызывающее большое число («цепь») превращений исходной молекулы благодаря регенерации активной частицы в каждом звене цепи.
Примером цепной реакции является взаимодействие водорода с хлором. Цепь зарождается распадом хлора под действием света:
Cl2 = 2Cl·
(Cl· – атом хлора, имеющий неспаренный электрон, – активная частица) и продолжается соответственно уравнениям:
H2 + Cl· = HCl + H·; H· + Cl2 = HCl + Cl· и т.д.
Пример 1. Относительно каких реакций из числа:
1) 4NH3 + 5O2 = 4NO + 6H2O 2) 2H2 + O2 = 2H2O 3) 2O3 = 3O2
можно сказать, что они являются сложными?
Решение. Безусловно, сложной является первая реакция, т.к. одновременное столкновение девяти молекул реагентов невозможно. Одновременное столкновение трех молекул во второй и двух молекул в третьей реакции возможно, но исследованиями установлено, что эти реакции также относятся к сложным: вторая протекает как цепная:
H2 + O2 = 2OH·
OH·+ H2 = H2O + H·
H· + O2 = OH· + ·O·
·O· + H2 = OH· + H· и т.д.,
а третья – как последовательная двустадийная:
1) O3 = O2 + O; 2) O + O3 = 2O2.
Таким образом, по виду химического уравнения определить простую реакцию невозможно, т.к. уравнение реакции отражает её стехиометрию, а не механизм.
В сложной реакции, состоящей из последовательных стадий, одна из простых стадий, как правило, протекала бы медленнее других, если бы каждую стадию провести отдельно. Такая стадия называется лимитирующей: скорость ее протекания определяет (лимитирует) скорость всей реакции.
|
|
|
3. Скорость реакции
Скорость реакции – это число элементарных актов взаимодействия, происходящих в единицу времени в единице объема для гомогенных реакций или на единице поверхности раздела фаз – для гетерогенных. Но элементарные взаимодействия атомов и молекул фиксировать, как правило, невозможно, поэтому о скоростях реакций судят по изменению концентрации реагентов или продуктов за определенный промежуток времени. Иногда вместо концентрации практикуется измерение других величин, связанных с концентрацией, – массы, давления, объема, электропроводности, окраски и т.д.
Обычно химическая реакция проводится в закрытой системе, т.е. без добавления реагентов извне. В большинстве случаев её скорость максимальна в начале, когда концентрации реагентов самые большие и число столкновений между молекулами максимально. По мере протекания реакции концентрации реагентов, число столкновений и скорость уменьшаются. Такова общая закономерность. Но встречаются реакции, скорость которых постоянна. Известны автокаталитические реакции (продукты реакции являются её катализаторами), скорость которых по мере их протекания сначала возрастает, а потом уменьшается, а также автоколебательные реакции, скорость которых то уменьшается, то увеличивается.
На скорость гомогенных реакций влияют природа и концентрация взаимодействующих веществ, температура и катализаторы. На скорость гетерогенных реакций, которые осуществляются на поверхности раздела фаз, влияет также величина этой поверхности, т.е. размер частиц твердого вещества, а на скорость цепных реакций – размеры и форма реакционного сосуда, так как при соударении промежуточных активных частиц с внутренней поверхностью реакционного сосуда они теряют свою активность и способность продолжать цепочку превращений.
4. Закон действующих масс
Влияние природы и концентрации реагентов на скорость реакции описывается законом действующих масс. Этот закон установлен опытным путем К. Гульдбергом и П. Вааге (1867) и теоретически обоснован Я. Вант-Гоффом (1877) с позиций молекулярно-кинетической теории газов. Для простых реакций закон действующих масс гласит: скорость простой реакции при постоянной температуре пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для простой реакции, записанной в общем виде:
аА + bВ = продукты,
математическое выражение закона действующих масс следующее:
V = k∙Са(А)∙Сb(В),
где V – скорость реакции, k – константа скорости реакции, С(А) и С(В) – молярные концентрации реагентов, а и b – кинетический порядок реакции по веществу А и В, соответственно.
Математическое выражение закона действующих масс называется кинетическим уравнением реакции.
Константа скорости реакции k, входящая в кинетическое уравнение, равна скорости реакции при концентрациях реагентов [A] = [B] = 1 моль/л. Константа скорости при постоянной температуре зависит только от природы реагентов и не зависит от их концентрации. Поэтому в химической кинетике реакции принято характеризовать не скоростью, которая по ходу реакции изменяется, а константой скорости, которая постоянна. Реакции, проходящие при одинаковых условиях, можно сравнивать по их константам скоростей.
Примечание. Особенность константы скорости реакции состоит в том, что ее единица измерения зависит от кинетического порядка реакции. Константа скорости реакции нулевого порядка измеряется в моль/(л×с) или моль∙л–1·с–1, константа скорости реакции первого порядка – в 1/с или с–1, а второго порядка – в л/(моль×c) или л∙моль–1×c–1).
В химической кинетике различают кинетический порядок по отдельному реагенту и общий кинетический порядок реакции. Для простых реакций кинетический порядок по реагенту равен коэффициенту перед этим веществом в уравнении, а общий кинетический порядок – сумме этих коэффициентов. Следовательно, общий кинетический порядок простой реакции равен ее молекулярности.
Пример 2. Напишите кинетические уравнения простых реакций между газообразными веществами:
1) C2H5OH = C2H4 + H2O; 2) 2HI = H2 + I2; 3) 2NO + Cl2 = 2NOCl.
Решение. 1) V = k С(C2H5OH); 2) V = k С2(HI); 3)V = k С2(NO)∙С(Cl2)
Пример 3. Определите кинетический порядок по реагентам и общий кинетический порядок простой реакции:
2NO(г) + H2(г) = N2O(г) + H2O(г).
Решение. Кинетический порядок этой реакции по оксиду азота (II) равен двум, по водороду – единице, а общий порядок равен трем, что совпадает с молекулярностью реакции.
Пример 4. Объясните, как изменяется скорость простой реакции:
2NO(г) + Cl2(г) = 2NOCl(г)
при увеличении концентрации только оксида азота (II) в три раза, только хлора в три раза и при одновременном увеличении концентрации обоих веществ в три раза?
Решение. Записываем кинетическое уравнение реакции:
V = k∙С2(NO)∙С(Cl2),
из которого видно, что кинетический порядок реакции по оксиду азота (II) равен двум, по хлору – единице, а общий – трём. Следовательно, при увеличении концентрации оксида азота в три раза скорость реакции увеличивается в 9 раз (три во второй степени), хлора – в три раза и обоих реагентов – в 27 раз.
В сложных последовательных реакциях закон действующих масс описывает скорость каждой отдельной простой (элементарной) стадии. Для всей сложной реакции закон действующих масс также применим, но кинетический порядок реакции по реагентам не совпадает с коэффициентами перед веществами. Так, если реакция
аА + bВ = продукты
сложная, то ее кинетическое уравнение имеет вид:
V = k Сn1(A)·Сn2(B),
где n1 и n2 – небольшие целые или дробные числа. Заранее они неизвестны и определяются опытным путем.
Пример 5. Реакцию 2H2(г) + O2(г) = 2H2O(г) провели сначала при одном давлении, а затем при давлении в 10 раз большем. Как изменилась скорость реакции во втором опыте по сравнению с первым, если кинетическое уравнение этой сложной цепной реакции имеет вид: V = k [H2]0,4 [O2]0,3?
Решение. Предположим, что было проведено два опыта. В первом опыте концентрации водорода и кислорода были одинаковыми и равными единице (1 моль/л); в этом опыте скорость реакции равна:
V = k С0,4(H2) С0,3(O2) = k 10,4 10,3 = 10,7 = 1.
Второй опыт проведен после увеличения давления в 10 раз, при этом концентрации реагентов также увеличились в 10 раз, потому что объём уменьшился в 10 раз (закон Бойля–Мариотта), а количества реагентов остались прежними. Во втором опыте скорость реакции равна:
V = k 100,4 100,3 = k 100,7 = 5.
Таким образом, при увеличении давления в 10 раз скорость данной реакции увеличивается в 5 раз
5. Определение кинетического порядка реакции
Чтобы узнать порядок реакции по какому-либо реагенту, необходимо определить, как зависит скорость реакции от концентрации этого реагента.
Пример 6. При увеличении концентрации одного из взаимодействующих веществ (концентрации других реагентов постоянны) в 2,5 раза скорость реакции возросла в 4,0 раза. Определить кинетический порядок реакции по этому веществу.
Решение. Обозначим вещество символом А, а кинетический порядок реакции по этому веществу символом х. Запишем кинетическое уравнение реакции для данного вещества до и после изменения концентрации:
V = k∙С x; 4,0∙V = k (2,5.С)x;
Разделим второе уравнение на первое и вычислим x:
4,0 = 2,5x; lg4,0 = x∙lg2,5; 
Таким образом, кинетический порядок реакции по этому веществу равен 1,5
Пример 7. Оксид азота (II) и водород при 1000 K взаимодействуют соответственно уравнению:
2NO(г) + 2H2(г) = N2(г) + 2H2O(г).
Была определена скорость реакции при различной концентрации реагентов, получены следующие результаты:
| С(NO), моль/л | 0,012 | 0,012 | 0,012 | 0,002 | 0,004 | 0,006 |
| С(H2), моль/л | 0,002 | 0,004 | 0,006 | 0,012 | 0,012 | 0,012 |
| V, моль/(л мин) | 0,20 | 0,40 | 0,60 | 0,30 | 1,20 | 2,70 |
Выведите кинетическое уравнение реакции и вычислите ее константу скорости.
Решение. В первых трех опытах концентрация NO постоянна, следовательно, увеличение скорости реакции происходит только благодаря увеличению концентрации водорода. В этих опытах при увеличении концентрации водорода в 2 раза скорость возрастает тоже в 2 раза, а при увеличении концентрации в 3 раза скорость возрастает тоже в 3 раза, следовательно, кинетический порядок реакции по водороду равен единице.
В четвертом–шестом опытах, наоборот, концентрация водорода постоянна, но меняется концентрация оксида азота, причем с увеличением его концентрации в 2 и в 3 раза скорость реакции увеличивается в 4 (два в квадрате) и в 9 (три в квадрате) раз. Следовательно, кинетический порядок реакции по NO равен двум, и кинетическое уравнение данной реакции имеет вид:
V = k С2(NO) С(H2)
Для расчета константы скорости реакции можно взять любой опыт, например, первый:

6. Кинетические уравнения гетерогенных реакций
Скорость гетерогенных реакций, протекающих на поверхности твердого реагента, зависит от его удельной поверхности и от концентраций реагентов, находящихся в газовой фазе или в растворе. Поэтому в кинетическое уравнение входит удельная поверхность твердого вещества. Например, для реакции:
CaO(к) + CO2(г) = CaCO3(г)
кинетическое уравнение имеет вид:
v = k·Sуд(CaO)·С(CO2),
в котором Sуд(CaO) – удельная поверхность твердого оксида кальция.
Удельной поверхностью твердого вещества называется поверхность единицы массы этого вещества. Удельная поверхность тем больше, чем сильнее измельчено вещество (при измельчении вскрывается «внутренняя поверхность»), поэтому при проведении реакций с твердыми веществами их предварительно измельчают.
Удельная поверхность по ходу реакции мало изменяется или вообще не изменяется, поэтому ее объединяют (перемножают) с константой скорости реакции. Получаемая при этом новая константа скорости реакции зависит не только от природы участвующих в реакции веществ, но и от удельной поверхности твердого реагента.
Пример 8. Напишите кинетическое уравнение гетерогенной реакции C(к) + O2(г) = CO2 (г), кинетический порядок которой по кислороду равен единице. Объясните, почему на тепловых электростанциях уголь перед сжиганием измельчают.
Решение. Кинетическое уравнение этой гетерогенной реакции такое:
V = k∙Sуд(C) С(O2) или V = k´ С(O2),
где k´ = k∙Sуд(C). Измельчение угля на тепловых электростанциях производится с целью увеличения скорости его сгорания, т.е. повышения производительности тепловых агрегатов.
7. Влияние температуры на скорость реакций
7.1. Уравнение Аррениуса
Зависимость скорости реакций от температуры выражается уравнением Аррениуса и правилом Вант-Гоффа. Уравнение Аррениуса имеет вид:
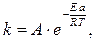
где k – константа скорости реакции, A – предэкспоненциальный множитель, e – основание натуральных логарифмов, R – молярная газовая постоянная, T – температура, Eа – энергия активации.
Наиболее важная величина в уравнении Аррениуса – энергия активации. Энергия активации – это та минимальная энергия молекул, которая необходима для того, чтобы при столкновении этих молекул произошло химическое взаимодействие. Молекулы, обладающие такой энергией, называются активными.
7.2. Теория переходного состояния
Энергия активации необходима для преодоления энергетического барьера, обусловленного отталкиванием электронных оболочек взаимодействующих молекул. По одной из теорий, разработанных в химической кинетике (теория переходного состояния), в ходе химического взаимодействия между молекулами образуется промежуточный активированный комплекс, в котором происходит перераспределение химических связей и образование молекул продуктов. Например, взаимодействие водорода и йода можно такой представить схемой:
 ®
® 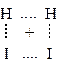 ®
® 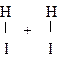
реагенты активированный комплекc продукты
Активированный комплекс – это переходное состояние, когда химические связи в молекулах реагентов ослаблены, но еще не разорваны, а связи в молекулах продуктов уже наметились, но еще не сформировались. Иными словами, в системе уже нет исходных веществ, но нет еще и продуктов реакции; осуществляется переход исходных веществ в продукты. Таким образом, энергия активации расходуется на образование промежуточного активированного комплекса.
На рис. 4 показано схематически изменение энергии молекул при переходе от исходных веществ А и В к продуктам реакции С и D через активированный комплекс А … В для экзотермических реакций. На этой диаграмме средняя энергия молекул реагентов обозначена Е1, продуктов – Е2, а переходного состояния – Е3. Разность Е1 – Е2 равна энтальпии реакции (видно, что энтальпия ∆Н зависит только от начального и конечного энергетического состояния веществ), а разность Е3 – Е1 равна энергии активации Еа данной реакции.
Энергия системы в переходном состоянии (Е3) максимальна, и это означает, что активированный комплекс крайне неустойчив.
На рис. 4 величина Еа´ = Е3 – Е2 – это энергия активации обратной реакции, она не равна энергии активации прямого процесса.
Примечание. Если энергия активации обратной реакции мало отличается от энергии активации прямого процесса, то химическая реакция – обратимая, т.е. она протекает одновременно и в прямом, и в обратном направлении.
Энергия активации необходима для преодоления отталкивания между молекулами, которое возникает при сближении молекул на близкие расстояния и препятствует их взаимодействию. Кроме того, энергия активации необходима для ослабления химических связей в исходных веществах. Следовательно, энергия активации зависит только от природы реагирующих веществ. Температура и концентрация реагентов на величину энергии активации не влияют.
Интересно сравнение численного значения энергии активации и энергии химических связей в молекулах взаимодействующих веществ. Например, для разрыва связей в молекуле водорода требуется 436, в молекуле йода 151 кДж/моль. В сумме это составляет 587 кДж/моль. Но энергия активации реакции между этими веществами рана 170–180 кДж/моль, что примернов 3–4 раза меньше. Это означает, что энергия активации необходима не для полного разрыва химических связей, а только для их ослабления, т.е. для образования промежуточного активированного комплекса.
Примечание. В уравнение Аррениуса входит предэкспоненциальный множитель, физико-химический смысл которого объясняется следующим образом.
Кроме наличия у молекул энергии, равной или большей Еа, необходима строго определенная («выгодная») ориентация (или в более общем случае – состояние) молекул в момент их столкновения. Это условие выражается стерическим фактором, от которого зависит величина предэкспоненциального множителя:
A = Z∙P,
где Z – общее число столкновений молекул в единицу времени; P – стерический фактор, меньший единицы.
Таким образом, величина предэкспоненциального множителя А показывает число «благоприятных» столкновений молекул, величина 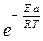 – долю активных столкновений, а константа скорости k – число активных столкновений, приводящих к взаимодействию.
– долю активных столкновений, а константа скорости k – число активных столкновений, приводящих к взаимодействию.
Энергия активации – самая важная в химической кинетике характеристика реакции. Она определяется экспериментально, и если не требуется большой точности её значения, то её можно вычислить по результатам только двух опытов.
Пример 9. Вычислите энергию активации некоторой реакции, константа скорости которой равна 83,9 при 600 К и 407,0 – при 640 К.
Решение. 1) Записываем уравнение Аррениуса в общем виде для двух констант скоростей:
 ;
; 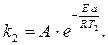
2) Для того, чтобы избавиться от неизвестной величины предэкспоненциального множителя А, делим большую константу скорости (k2) на меньшую (k1):
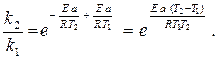
3) Полученное выражение логарифмируем и выражаем из него энергию активации:

4) Вычисляем логарифм отношения данных констант скоростей:
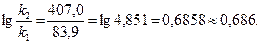
5) Вычисляем энергию активации:
 Дж/моль» 126 кДж/моль.
Дж/моль» 126 кДж/моль.
Пример 10. Реакция между тиосульфатом натрия и серной кислотой:
Na2S2O3 + H2SO4 = Na2SO4 + S¯ + SO2 + H2O
используется в лабораторном практикуме по химии для установления некоторых закономерностей химической кинетики. Предположим, что реакция проходит за 110 с при 20 °С и за 45 с при 30 °С (при одинаковых концентрациях реагентов). Вычислить энергию активации реакции.
Решение. Скорость реакции и константа скорости реакции пропорциональны величине, обратной времени реакции:
V2: V1 = k2: k1 = 
Следовательно, в выражении для расчета Еа, полученном в предыдущем примере, отношение k2: k1 можно заменить отношением t1: t2 и вычислить энергию активации:
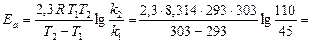 65960 Дж/моль» 66 кДж/моль.
65960 Дж/моль» 66 кДж/моль.
МОДУЛЬ III. РАСТВОРЫ И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
ЛЕКЦИИ 9 и 10
Тема 9. Способы выражения концентрации растворов
По этой теме необходимо знать и уметь следующее.
1.(72). Знать названия, обозначения, определения и соответствующие определениям формулы шести способов выражения концентрации растворов: массовая доля, молярная, эквивалентная, титр, моляльность и мольная доля.
2.(73). Проводить расчеты на переход от одного способа выражения концентрации к другому.
3.(74). Проводить расчеты параметров раствора (концентрация, масса, объем, плотность), полученного методом растворения чистого вещества (твердого, жидкого, газообразного), разбавления водой данного раствора или выпариванием воды из раствора.
4.(75). Вычислять концентрацию раствора, получаемого смешиванием двух растворов с известной концентрацией.
5.(76). Вычислять массу вещества или объем раствора, необходимые для проведения реакции с другим раствором и массу (объем) вещества полученную при проведении данной реакции.
6.(77). Знать закон эквивалентов для реакций в растворах, вычислять концентрацию раствора кислоты или щёлочи по результатам основно-кислотного титрования.
7.(78). Проводить вычисления, связанные с коэффициентом растворимости вещества.
По этой теме проводится практическое занятие и лабораторная работа.
Тема 10. Образование и свойства растворов
По этой теме необходимо знать и уметь следующее.
1.(79). Знать сущность химической теории растворения, проводить вычисления, связанные с энтальпией растворения и гидратацией вещества.
2.(80). Приводить примеры растворов неэлектролитов, уметь вычислять свойства растворов неэлектролитов: понижение давления пара, повышение и понижение температур кипения и замерзания, осмотическое давление.
3.(81). Вычислять молекулярную массу неэлектролита по температурам кипения или замерзания его раствора.
4.(82). Приводить примеры растворов электролитов, объяснять механизм их электролитической диссоциации, записывать схемы диссоциации кислот, оснований, солей (средних, кислых, основных).
5.(83). Объяснять смысл константы и степени диссоциации электролита, уметь записывать выражения для константы диссоциации слабых электролитов.
6.(84). Знать закон разбавления Оствальда (его формулировку и математическое выражение) и проводить по нему расчеты.
7.(85). Вычислять водородный показатель растворов сильных и слабых электролитов.
8.(86). По справочным значениям произведения растворимости вычислять концентрацию насыщенного раствора данного малорастворимого вещества и объем воды, необходимый для растворения данной массы малорастворимого вещества.
Тема 11. Реакции в растворах электролитов
По этой теме необходимо знать и уметь следующее.
1.(87). Записывать в молекулярном и ионном виде уравнения ионообменных реакций с участием и образованием нерастворимого вещества, газа, слабого электролита, перевода кислых и основных солей в нормальные.
2.(88). Устанавливать направление ионообменной реакции, если в левой и правой частях её уравнения имеются нерастворимые вещества или слабые электролиты.
3.(89). Определять по формуле соли тип её гидролиза и среду её раствора.
4.(90). Записывать молекулярные и ионные уравнения гидролиза солей.
5.(91). Сравнивать соли по полноте их гидролиза (без расчетов).
6.(92). Устанавливать, что происходит с гидролизом данной соли (усиление, ослабление, изменений нет) при разбавлении раствора и введении в её раствор других веществ.
7.(93). Вычислять степень гидролиза соли и водородный показатель её раствора, если известна концентрация H+- или OH–-ионов в этом растворе; вычислять концентрацию H+- и OH–-ионов в растворах солей, если известен водородный показатель этих растворов.
Содержание лекции 9.
1. Дисперсные системы и растворы
2. Химическая теория растворов
3. Термодинамика растворения
4. Концентрация растворов
5. Растворимость веществ
6. Произведение растворимости
7. Растворы неэлектролитов
7.1. Идеальный раствор
7.2. Осмос и осмотическое давление
7.3. Давление пара
7.4. Температуры кипения и замерзания
Химия растворов является теоретической основой галургии, гидрометаллургии и аналитической химии. В растворах осуществляется синтез и анализ большинства неорганических соединений, и даже классификация веществ основана на их свойствах в водных растворах. Все важнейшие биологические системы, такие как цитоплазма, кровь, лимфа и другие, являются водными растворами солей, белков, углеводов, липидов. Большинство биохимических реакций в живых организмах протекают в растворах. Поэтому растворы представляют особый, межпредметный интерес для химии, биологии, физиологии и медицины.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 5578; Нарушение авторских прав?; Мы поможем в написании вашей работы!