
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Осмос и осмотическое давление
|
|
|
|
Идеальный раствор
Растворы неэлектролитов
Для количественного описания общих свойств растворов используется модель идеального раствора. Идеальным называется раствор, в котором все частицы имеют одинаковую энергию межмолекулярного взаимодействия и одинаковые размеры и образование которого не сопровождается тепловым эффектом и изменением объёма.
Все растворы обладают некоторыми свойствами, которые не зависят от природы растворённого вещества и зависят только от концентрации: диффузия и осмос, давление пара, температура кипения и замерзания. Эти свойства называются коллигативными. Теоретическое описание этих свойств с высокой точностью возможно лишь для идеального раствора.
К свойствам идеального раствора наиболее близки разбавленные растворы неэлектролитов. В растворах неэлектролитов растворённое вещество находится в виде молекул – нейтральных частиц, которые не проводят электрический ток. Такие растворы образуются при растворении в воде одноатомных газов и газов с неполярной ковалентной связью в молекулах, а также многих органических соединений (спирты, сахар, формалин и т.д.).
Раствор представляет собой гомогенную систему. Частицы растворённого вещества и растворителя находятся в беспорядочном тепловом движении и равномерно распределяются по всему объёму раствора.Процесс самопроизвольного распределения вещества по всему предоставленному ему объёму называется диффузией. В ходе диффузии возрастает энтропия, поскольку беспорядочность распределения частиц в растворе увеличивается по сравнению с исходным состоянием. Возрастание энтропии является причиной самопроизвольного протекания процесса диффузии, его движущей силой.
|
|
|
Можно создать условия, при которых диффузия идёт только в одном направлении. Для этого раствор и растворитель необходимо разделить плёнкой, через которую проходят молекулы растворителя, но не проходят частицы растворённого вещества. Такая плёнка называется полупроницаемой перегородкой; полупроницаемые перегородки существуют в природе, а также их получают искусственно. В этом случае возможна только односторонняя диффузия растворителя в раствор. Процесс односторонней диффузии растворителя в раствор через полупроницаемую перегородку называется осмосом.
Если взять стеклянную трубку, перекрытую с одного конца полупроницаемой перегородкой, заполнить часть трубки раствором и опустить её в сосуд с водой, то вследствие осмоса вода из сосуда диффундирует в трубку с раствором. По мере диффузии воды объём раствора в трубке и давление на перегородку со стороны раствора увеличиваются. Таким образом, возникает гидростатическое давление столба жидкости высотой h, препятствующее диффузии растворителя в раствор. При некотором давлении наступает равновесие: сколько воды проходит в раствор, столько же выталкивается обратно увеличившимся давлением. Равновесное давление раствора, препятствующее диффузии растворителя через перегородку, называется осмотическим давлением.
Для разбавленных растворов неэлектролитов зависимость осмотического давления (p) от молярной концентрации (С) и температуры (Т) выражается уравнением (Вант-Гофф, 1887):
Р = СМ∙R∙T
Молярная концентрация СМ равна отношению количества растворённого вещества n к объёму раствора V, а количество вещества равно его массе, поделённой на молярную массу M. Поэтому уравнение Вант-Гоффа можно записать в таком виде:
 или
или 
Последнее уравнение является уравнением состояния идеального газа. Следовательно, осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворённое вещество, если бы при данной температуре оно в виде газа занимало объём раствора (осмотический закон Вант-Гоффа).
|
|
|
Осмотическое давление – это большое давление. Например, в одном литре одномолярного раствора неэлектролита находится один моль растворённого вещества. Это количество вещества в виде газа при нормальных условиях заняло бы объём 22,4 л. Это означает, что осмотическое давление одномолярного раствора неэлектролита в 22,4 раза больше нормального атмосферного давления, то есть оно равно 2262,4 кПа.
Осмос играет важную роль в росте и развитии растений и животных, т.к. процессы обмена и усвоения питательных веществ осуществляются благодаря осмосу. В научных исследованиях осмотическое давление измеряют для определения молярных масс растворённых веществ.
При внешнем давлении, большем осмотического, наблюдается обратный осмос, т.е. диффузия через полупроницаемую перегородку молекул растворителя. Обратный осмос применяется в технике для очистки сточных вод и для регенерации дорогостоящих растворителей.
Пример 13. Определите осмотическое давление при 17 °С раствора, в 500 мл которого содержится 17,1 г сахара С12H22O11.
Решение. Молярная масса сахара равна 342 г/моль, температура раствора равна 290 К. Осмотическое давление раствора вычисляем по уравнению Вант-Гоффа:
p =  = 241106 Па» 241 кПа
= 241106 Па» 241 кПа
Пример 14. Для определения неизвестного одноатомного спирта взяли 11,5 г этого вещества, растворили в воде, объём довели до 500 мл и измерили осмотическое давление полученного раствора, которое оказалось равным 1218 кПа. Установите формулу спирта.
Решение. Из уравнения Вант-Гоффа выражаем и вычисляем молярную массу неэлектролита:
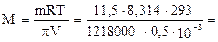 46 г/моль
46 г/моль
Среди одноатомных спиртов молярную массу 46 г/моль имеет этиловый спирт.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1275; Нарушение авторских прав?; Мы поможем в написании вашей работы!