
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Давление пара
|
|
|
|
При любой температуре идет испарение жидкости. В закрытых сосудах одновременно с испарением идет обратный процесс – конденсация. В состоянии равновесия, когда скорости процессов испарения и конденсации равны, пар над жидкостью называется насыщенным. Его давление характеризует летучесть жидкости: чем выше давление насыщенного пара над жидкостью, тем более она летуча. Например, давление насыщенного пара при 20 °С над водой равно 2337 Па, ртутью – 0,173 Па, спиртом – 5866 Па, ацетоном – 24227 Па. Это означает, что спирт и ацетон более летучие, а ртуть – менее летучая, чем вода, жидкости.
При нагревании жидкостей давление насыщенного пара над ними увеличивается. Например, давление насыщенного пара над водой (Па) равно: 610,7 (0 °С), 1227 (10 °С), 2337 (20 °C), 7334 (40 °С), 19920 (60 °С), 43360 (80 °С), 101325 (100 °С). Температура, при которой давление насыщенного пара становится равным атмосферному давлению (101325 Па), является температурой кипения жидкости; для воды она равна 100 °С (373,15 К).
Давление насыщенного пара над раствором (P) слагается из парциальных давлений растворителя (p1) и растворённого вещества (p2):
P = p1 + p2
Парциальные давления паров компонентов смеси зависят от количественного состава смеси: согласно закону Генри, они пропорциональны их мольным долям (N) в смеси:
p1 = P1º∙N, p2 = P2º∙N2,
где P1º и P2º – давления насыщенных паров чистых растворителя и растворённого вещества;
N1 и N2 – мольные доли растворителя и растворённого вещества в растворе.
Таким образом, давление насыщенного пара над раствором равно:
Р = p1 + p2 = P1º∙N1 + P2º∙N2
Если растворённое вещество нелетучее (нелетучим считается вещество, температура кипения которого более чем на 150 К отличается от температуры кипения растворителя),
то P2° = 0 и p2 = 0. В этом случае давление насыщенного пара над раствором равно парциальному давлению его летучего компонента – растворителя:
|
|
|
Р = p1 = P1º∙N1
Давление насыщенного пара над раствором (P) меньше давления насыщенного пара над чистым растворителем (P1°). Если разность давлений обозначить DP, то после подстановок и математических преобразований можно получить следующие соотношения:
∆Р = Р1º – Р, ∆Р = Р1º – Р1º∙N1, ∆Р = Р1º∙(1 – N1), ∆Р = Р1º∙N2; 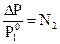
Таким образом, понижение давления насыщенного пара над раствором пропорционально, а относительное понижение давления насыщенного пара равно мольной доле растворённого вещества.
Эта закономерность, установленная французским химиком Раулем (1887) при изучении растворов неэлектролитов, называется первым законом Рауля.
Практическое значение первого закона Рауля состоит в том, что по давлению насыщенного пара, определяемого опытным путём, можно рассчитать мольную долю и молярную массу растворённого вещества. Если количества растворённого вещества и растворителя обозначить n1 и n2, то математическое выражение первого закона Рауля принимает следующий вид:
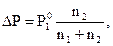
где n2 – неизвестная величина.
В разбавленных растворах n1 >> n2, поэтому n1 + n2» n1. Таким образом, для разбавленных растворов получаем упрощённые выражения для вычисления мольной доли и молярной массы растворённого вещества:
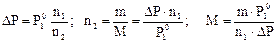
Пример 15. Вычислитt давление насыщенного пара над 4%-м водным раствором глюкозы С6H12O6 при 40 °С.
Решение. Принимаем массу раствора 100 г, тогда масса воды в нём составит 96 г, а глюкозы 4 г. Молярная масса воды равна 18 г/моль, а глюкозы 180 г/моль. Давление насыщенного пара над чистой водой при 40 °С равно 7374 Па (справочная величина).
1) Определяем количество воды (n1) и глюкозы (n2) и мольную долю глюкозы (N2) в растворе:
|
|
|
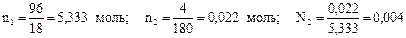
2) Вычисляем величину понижения давления пара над раствором:
DР = 7374 ∙ 0,004 = 29 Па
3) Вычисляем давление насыщенного пара над раствором:
Р = 7374 – 29 = 7345 Па
Пример 16. При 30 °С давление насыщенного пара воды равно 4241 Па, а давление насыщенного пара над 5%-м водным раствором карбамида (мочевины) уменьшается до 4174 Па. Вычислите молярную массу карбамида.
Решение. В 100 г раствора содержится 5 г карбамида, молярная масса М которого неизвестна, и 95 г воды (молярная масса М = 18 г/моль).
1) Количество воды (n1) равно: 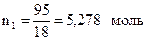
2) Понижение давления пара (DR) равно: DR = 4241 – 4174 = 67 Па
3) По выражению, полученному для разбавленных растворов неэлектролитов (см. выше), вычисляем молярную массу растворённого вещества карбамида:

Данный пример является учебной задачей, поэтому формула растворённого вещества карбамида известна: СО(NH2)2. Расчёт молярной массы по формуле подтверждает полученный результат.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 2948; Нарушение авторских прав?; Мы поможем в написании вашей работы!