
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионное произведение воды
|
|
|
|
Константы диссоциации слабых электролитов приводятся в справочниках. Слабыми электролитами являются гидроксид аммония и кислоты сероводородная, сернистая, азотистая, ортофосфорная, циановодородная, уксусная и ряд других.
Между степенью диссоциации (α), константой диссоциации (К) и молярной концентрацией раствора (C) существует взаимосвязь, установленная В. Оствальдом (1888). Эта взаимосвязь, которая называется законом разбавления Оствальда, выражается уравнением:
a ≈ 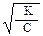
Вывод закона разбавления Оствальда можно показать на примере циановодородной кислоты HCN, схема диссоциации и выражение константы диссоциации которой приведены выше.
Если молярная концентрация электролита равна C, а степень диссоциации α, то [H+] = [CN–] = α∙C, а [HCN] = (1 – α)∙C и, следовательно,
К = 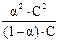 =
= 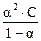
Поскольку для слабых электролитов α << 1, то можно принять, что 1 – α ≈ 1. Тогда:
К ≈ a2∙С и a ≈ 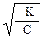
Вода является слабым электролитом. Схема её диссоциации и выражение константы диссоциации таковы:
Н2О D Н+ + ОН–; 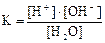
При 25 ºС константа диссоциации воды составляет 1,821·10–16, т.е. очень мала. По расчётам при этой температуре диссоциирует лишь одна из 55 млрд. молекул воды. Поэтому концентрацию воды считают постоянной и объединяют её с константой диссоциации воды в одну постоянную, обозначая её Kw или К(H2O):
Кw = [Н+]∙[ОН–] = К(H2O)
Величина Kw называется ионным произведением воды. При 25 ºС масса одного литра воды равна 997,07 г, а молярная масса воды равна 18,0153 г/моль (точное значение), следовательно, концентрация воды [H2O] равна 997,07: 18,0153 = 55,35 моль/л. Вычисляем ионное произведение воды при 25 ºС:
|
|
|
Кw = [Н+]∙[ОН–] = К(H2O) = 1,821·10–16·55,35 = 1·10–14
Постоянство ионного произведения воды означает, что как бы не менялись в водном растворе молярные концентрации ионов H+ и ОН–, их произведение при каждой данной температуре остаётся неизменным.
В чистой воде концентрации ионов H+ и ОН– одинаковы и равны по 10–7 моль/л (при 25 ºС). Предположим, что к воде добавлена соляная кислота и её концентрация в растворе стала равна 0,001 моль/л. При этом, в соответствии с принципом Ле Шателье, равновесие диссоциации воды нарушится и пойдёт обратный процесс образования молекул Н2О из ионов. При этом гидроксид-ионы ОН– не исчезают из раствора совсем, но их концентрация с 10–7 моль/л уменьшается до величины, которую можно вычислить из выражения для ионного произведения воды:
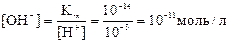
Если же к воде добавить щелочь и её концентрация составит, например, 0,02 моль/л, то концентрация Н+-ионов снизится с 10–7 до 5·10–13 моль/л.
Примечание. Диссоциация воды является эндотермическим процессом, поэтому, в соответствии с принципом Ле Шателье, при повышении температуры диссоциация воды и ионное произведение увеличиваются: при 0 ºС ионное произведение равно 1,1·10–15, при 18 ºС – 5,7·10–15, при 25 ºС – 1·10–14, при 50 ºС – 5,5·10–14, при 100 ºС – 5,9·10–13.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1834; Нарушение авторских прав?; Мы поможем в написании вашей работы!