
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение и свойства ферментов
|
|
|
|
ФЕРМЕНТЫ (энзимы) - это высокоспецифичные белки, выполняющие функции биологических катализаторов. Катализатор - это вещество, которое ускоряет химическую реакцию, но само в ходе этой реакции не расходуется.
Какие условия необходимы для химического взаимодействия молекул, чтобы произошла химическая реакция?
1) Молекулы должны сблизиться (столкнуться). Но не всякое столкновение приводит к взаимодействию.
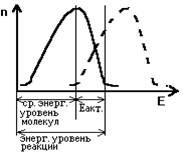
2) Необходимо, чтобы это столкновение стало эффективным - завершилось бы химическим превращением. Обязательное условие для эффективности столкновения - чтобы запас энергии молекул в момент столкновения был не ниже энергетического уровня реакции.
ЭНЕРГЕТИЧЕСКИЙ УРОВЕНЬ РЕАКЦИИ - это запас энергии, которым должны обладать молекулы, чтобы их столкновение стало эффективным (чтобы произошла химическая реакция). Этот запас энергии является постоянной характеристикой (константой) для каждой данной реакции.
СРЕДНИЙ ЭНЕРГЕТИЧЕСКИЙ УРОВЕНЬ МОЛЕКУЛ – это энергия, которой обладает большинство молекул системы в данный момент времени. Этасредняя величина энергетического запаса, которая характеризует совокупность данных молекул в данных конкретных условиях (температура, давление и другие). Энергетический запас молекул - это понятие статистическое (вероятностное). Молекулы постоянно находятся в тепловом движении. Поэтому энергетический запас каждой из них все время изменяется, колеблется около величины, которая и представляет собой СРЕДНИЙ ЭНЕРГЕТИЧЕСКИЙ УРОВЕНЬ МОЛЕКУЛ.
|
В каждый момент времени наибольшая доля молекул данной совокупности обладает именно таким СРЕДНИМ запасом энергии. И чем больше отличается энергия определенной группы молекул от среднего энергетического уровня (в любую сторону), тем малочисленнее эта группа. В любой совокупности молекул ее определенная доля обладает такой энергией, которая выше среднего энергетического уровня и достаточна для протекания химической реакции.
|
|
|
РАЗНОСТЬ между СРЕДНИМ ЭНЕРГЕТИЧЕСКИМ УРОВНЕМ МОЛЕКУЛ и ЭНЕРГЕТИЧЕСКИМ УРОВНЕМ РЕАКЦИИ называется энергетическим барьером или ЭНЕРГИЕЙ АКТИВАЦИИ (Пакт.). Чем больше эта энергия активации, тем медленнее идет химическая реакция.
КАК УСКОРИТЬ ХИМИЧЕСКУЮ РЕАКЦИЮ? Повышение среднего энергетического уровня молекул (повышение температуры, давления и других параметров среды, которое используют на химических заводах и фабриках) НЕВОЗМОЖНО для живых организмов, которые нормально функционируют только при постоянных значениях температуры, давления и других параметров. Невозможен и другой путь - уменьшение энергии активации путем снижения энергетического уровня реакции, поскольку эта величина является постоянной характеристикой данной реакции.
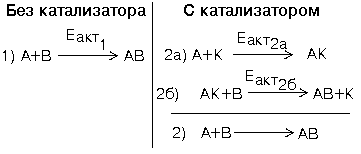
Поэтому, только явление катализа (применение катализаторов) может обеспечить ускорение химических реакций в живых организмах. Рассмотрим две реакции (смотрите рисунок).
|
В общем случае энергии активации реакций 1, 2а и 2б не совпадают между собой, и все разнообразие возможных вариантов можно разделить на две группы:
1) Еакт2а и/или Еакт2б БОЛЬШЕ, чем Еакт1.
Во всех таких случаях реакция образования вещества "АВ" с участием вещества "К" пойдет медленнее. Значит, вещество "К" является ИНГИБИТОРОМ (замедлителем) этой реакции.
2) Еакт2а и/или Еакт2б МЕНЬШЕ, чем Еакт1.
В этих случаях реакция с участием вещества "К" пойдет быстрее, чем без него. Значит, вещество "К" является КАТАЛИЗАТОРОМ (ускорителем) данной химической реакции.
КАТАЛИЗАТОР - это вещество, которое направляет реакцию по такому обходному пути, на котором энергетические барьеры ниже.
|
|
|
Рассмотренные реакции можно представить в виде "вертикального среза" через вершину вулкана, кратер которого имеет неодинаковые по высоте края.

|
На этом рисунке видно, что энергия, которую надо затратить для "подъема" молекулы от среднего энергетического уровня реакции, полностью компенсируется при самостоятельном "скатывании" молекулы по склону "вулкана". При дальнейшем самопроизвольном "скатывании" до подошвы "вулкана" (то есть, до среднего энергетического уровня молекул, которые являются продуктами данной реакции). Энергия, которая при этом выделяется, называется "ЭНЕРГЕТИЧЕСКИЙ ИТОГ РЕАКЦИИ".
ЭНЕРГЕТИЧЕСКИЙ ИТОГ РЕАКЦИИ - это разность между энергетическим уровнем исходных веществ (субстратов) и энергетическим уровнем продуктов реакции.
Энергетический итог реакции не зависит от пути, по которому идет реакция (он одинаков и для реакции с участием катализатора, и для реакции без его участия). Он не зависит и от величины энергии активации - от нее зависит только скорость протекания каждого из путей этой реакции.
Это видно из УРАВНЕНИЯ АРРЕНИУСА:

Вывод из уравнения Аррениуса: так как энергия активации в этом уравнении входит в показатель степени, то даже маленькое изменение энергии активации приводит к большим изменениям скорости реакции.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 359; Нарушение авторских прав?; Мы поможем в написании вашей работы!