
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы фазовых превращений многофазных систем
|
|
|
|
ФАЗОВЫЕ СОСТОЯНИЯ И ПРЕВРАЩЕНИЯ УГЛЕВОДОРОДНЫХ СИСТЕМ
Нефть и газ в залежи в зависимости от давления Р, температуры Т и состава может находиться в разных агрегатных состояниях. В одних случаях газовая (паровая) фаза полностью растворена в жидкой фазе, а в других – залежь имеет газовую шапку, т.е. над поверхностью жидкой нефти имеются газы, находящиеся в фазовом равновесии с нефтью.
Известно, что индивидуальное вещество (метан, этан, углекислый газ и т.д.) может одновременно находиться во всех трех фазах. Чтобы определить или предсказать, в каких именно фазовых состояниях находится то или иное вещество и вся система в целом, можно воспользоваться правилом фаз Гиббса, справедливое для любой системы в состоянии термодинамического равновесия:
n-k+2=f,
где п— число компонентов; k— число фаз; f —число независимых степеней свободы системы.
Под степенями свободы подразумеваются такие независимые переменные, как температура, давление и состав фаз. Так, индивидуальные вещества, находящиеся в двухфазном состоянии (например, пар и жидкость), имеют одну степень свободы (n=1; k+2; f=1). Для определения всех свойств фаз достаточно задаться одним лишь значением температуры. Индивидуальные вещества, находящиеся в трехфазном состоянии, не имеют степеней свободы (это состояние выражается тройной точкой на соответствующей диаграмме).
Двухкомпонентные системы, находящиеся в двухфазном состоянии, имеют две степени свободы, т. е. состояние такой системы будет определяться температурой и давлением. Если в двухфазном состоянии находится трехкомпонентная система, то число степеней свободы будет равно 3. Состояние такой системы определяется температурой, давлением и каким-либо параметром, выражающим состав фаз, например концентрацией одного компонента в какой-либо фазе или отношением концентрации одного компонента к концентрации другого в той же фазе.
|
|
|
Фазовое равновесие каждого углеводородного компонента многокомпонентной смеси характеризуется уравнением:
y =kx,
где y - мольная концентрация данного компонента в паровой фазе,
x - мольная концентрация этого компонента в жидкой фазе,
k - константа фазового равновесия.
Константа равновесия определяется экспериментально, т.к. при большом числе компонентов расчеты их весьма сложны. Однако обычно можно ограничиться учетом основных углеводородных компонентов в данной залежи и, зная давление и температуру, установить расчетным путем, в каком фазовом состоянии находится смесь (и, например, на основе этого сделать вывод о высоте газовой шапки, предсказать ее изменение при изменении термодинамических параметров, т.е. изменении фазового состояния).
В общем виде зависимость температуры фазового перехода от давления дается уравнением Клаузиуса-Клапейрона:
 ,
,
где Т и Q – соответственно температура и теплота фазового перехода; 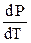 - производная, которая показывает наклон кривой на фазовой диаграмме в координатах «Р – Т»; DV – изменение объема системы в результате фазового перехода.
- производная, которая показывает наклон кривой на фазовой диаграмме в координатах «Р – Т»; DV – изменение объема системы в результате фазового перехода.
Растворение данного газообразного компонента в жидкости будет происходить до тех пор, пока парциальное давление его в газовой фазе не сравнится с парциальным давлением в жидкости (закон Рауля), т.е.
Р1=xР2,
где Р1 – парциальное давление газообразного компонента, растворенного в жидкости; Р2 – давление насыщенных паров этого компонента при данной температуре; x - мольная концентрация данного компонента в жидкости.
При установившемся равновесии фаз парциальные давления каждого компонента в газовой и жидкой фазах равны. Константа фазового равновесия зависит от давления и температуры: с повышением температуры растворимость газа уменьшается, и, следовательно, снижается мольная концентрация его в жидкой фазе.
|
|
|
Для прогнозирования фазовых превращений углеводородов используют приближенные (идеализированные) расчеты, в основе которых лежит закон Дальтона-Рауля
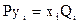 ,
,
где P – общее давление смеси; yi - молярная концентрация компонентов в газовой фазе; Qi – давление насыщенных паров компонентов в чистом виде; х i – молярная концентрация компонентов в жидкой фазе. Причем, очевидно, что Pyi –парциальное давление i-го компонента в паровой фазе; Qiхi – парциальное давление того же компонента в жидкой фазе.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 662; Нарушение авторских прав?; Мы поможем в написании вашей работы!