
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коагуляция гидрофобных дисперсных систем электролитами
|
|
|
|
Наименьшая концентрация электролита, при которой начинается коагуляция (медленная) называется порогом коагуляции (СМ). Для осуществления быстрой коагуляции требуется такая концентрация 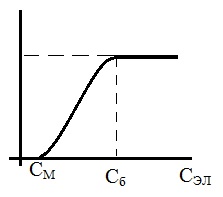 электролита (Сб), после увеличения которой скорость коагуляции остается постоянной. Введение электролита снижает потенциальный барьер, который при быстрой коагуляции равен нулю (
электролита (Сб), после увеличения которой скорость коагуляции остается постоянной. Введение электролита снижает потенциальный барьер, который при быстрой коагуляции равен нулю ( ).
).
В соответствии с теорией ДЛФО введение электролита в дисперсную систему вызывает сжатие ДЭС на поверхности частиц. Последнее может происходить как за счет уменьшения электрического потенциала в результате специфической адсорбции ионов на поверхности, так и за счет ограничения диффузии противоионов в раствор в связи с увеличением его ионной силы  :
: 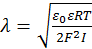 .
.
По преобладанию того или иного механизма процесса коагуляции ее делят на нейтрализационную и концентрационную. При концентрационной снижается  . При нейтрализационной снижается потенциал
. При нейтрализационной снижается потенциал 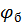 в результате специфической адсорбции ионов в слое Гельмгольца.
в результате специфической адсорбции ионов в слое Гельмгольца.
Нейтрализационная коагуляция более характерна для систем с маленьким 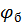 . При специфической адсорбции ионов возможна перезарядка поверхности частиц. Специфичность адсорбции повышается с увеличением заряда иона, поэтому вклад нейтрализационной коагуляции растет при переходе к электролитам с многозарядными ионами.
. При специфической адсорбции ионов возможна перезарядка поверхности частиц. Специфичность адсорбции повышается с увеличением заряда иона, поэтому вклад нейтрализационной коагуляции растет при переходе к электролитам с многозарядными ионами.
Преобладающее влияние ионной силы среды характерно для систем с высоким зарядом поверхности частиц и для индифферентных электролитов, не способных к специфической адсорбции.
Коагуляция вызывается одним из ионов электролита: или катионом, или анионом, т.е. ионом противоположным заряду поверхности.
Согласно теории ДЛФО на величину порога коагуляции существенное влияние оказывает величина заряда противоиона:
|
|
|

Отсюда следует, что если порог коагуляции однозарядного иона принять за единицу, то для других ионов получим ряд:
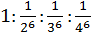 или
или 
Однако существует и эмпирический ряд Шульце и Гарди, который имеет вид:
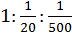
На величину порога коагуляции оказывает влияние размер иона-коагулятора индифферентного электролита: чем меньше радиус иона, тем больше его гидратация и, следовательно, тем больше порог коагуляции.

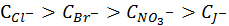
Большой радиус гидратированного иона препятствует его вхождению в слой Гельмгольца.
Коагуляция золей смесями электролитов вызывает появление одного из трех явлений: антагонизма, синергизма или аддитивного действия ионов.

Существует явление привыкания золей, на котором основана коллоидная защита. Известны ряды защитных чисел: золотой, серебряный, железный, рубиновый и др.
Если электролит добавлять к золю небольшими порциями, то в итоге коагуляция наступает при более высокой пороговой концентрации СК, чем при внесении сразу большого его количества. Такое явление называется привыканием золя.
Устойчивость золей против коагуляции возрастает в присутствии ВМС: белков, полисахаридов и др.
Способность защищать золи от коагуляции количественно выражают защитным числом, равным силу сухого ВМС, защищающего 10 мл золя от коагуляции при приливании к нему 1 мл 10% раствора NaCl.
Наиболее сильным защитным действием обладают белки: желатин, козеин (0,01 – 0,1); более слабым – крахмал, декситрин (20 – 45).
Суть коллоидной защиты состоит в том, что благодаря сольватно-адсорбционным слоям повышается гидрофильность коллоидных частиц.
Растворы ВМС используются не только для защиты от коагуляции, но и для ускорения этого процесса. Для этого используют флокулянты, т.е. вещества ускоряющие процесс образования хлопьев. Наиболее распространенным в водоочистке является полиакриламид: (–CH2–CH(CONH2)–)n с M ~ 106.
|
|
|
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 843; Нарушение авторских прав?; Мы поможем в написании вашей работы!