
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергетика конденсационного образования дисперсных систем
|
|
|
|
Процессы образования дисперсных систем схематично представлены на рис. 1. Здесь под состоянием 1 понимается макрофаза вещества А в твердом (кристаллическом) агрегатном состоянии. Состояние 2 соответствует дисперсной системе вещества А в его жидком растворе. Наконец, состояние 3 соответствует истинному (молекулярному) раствору этого вещества. Образования дисперсной системы, как следует из рисунка, может быть осуществлено двумя путями: диспергированием (переход 1 – 2) или кристаллизацией – (переход 3 – 2). Подобная схема может быть использована также при иллюстрации процессов образования дисперсных систем, если вещество А находится в жидком агрегативном состояние. В этом случае переход 1 – 2 характеризует процесс эмульгирования, а переход 3 – 2 – процесс конденсации вещества А из его паров. В литературе принято, независимо от агрегативного состояние вещества А, определять переход 3 -2 как процесс конденсационного образования дисперсной системы. Указанный процесс сопровождается изменением агрегатного состояния и химического состава дисперсной фазы по сравнению с исходной макрофазой, т. е. фазовым превращением (возникновения капель жидкости в паре или в жидкости, кристалликов в растворе и т.д.). В силу этого в процессе перехода системы из состояния 3 в состояние 2 потенциалы вещества в различных его состояниях отличаются друг от друга, т. е.

Рис. 1. Схема возможных методов образования дисперсных систем
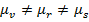
Работа образования частицы дисперсной фазы в таком процессе равна изменению потенциала Гиббса △ 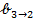 . С другой стороны, в соответствии с законом Гесса, эту величину можно представить как сумму изменений потенциала △
. С другой стороны, в соответствии с законом Гесса, эту величину можно представить как сумму изменений потенциала △ 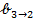 при переходе из состояние 3 в 1, а затем из состояния 1 в 2, т.е.
при переходе из состояние 3 в 1, а затем из состояния 1 в 2, т.е.
|
|
|
△ 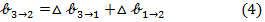
Здесь  соответствует работе переноса
соответствует работе переноса  молей вещества из жидкой фазы (состояния 3) в стабильную твердую макрофазу (состояние 1) – т.е. химической работе:
молей вещества из жидкой фазы (состояния 3) в стабильную твердую макрофазу (состояние 1) – т.е. химической работе:


или

где  - числом молей вещества; V – оббьем твердой макрофазы;
- числом молей вещества; V – оббьем твердой макрофазы; 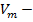 мольный оббьем вещества в жидкой макрофазе, равной М/
мольный оббьем вещества в жидкой макрофазе, равной М/  (М – мольная масса и 𝜌 – плотность вещества).
(М – мольная масса и 𝜌 – плотность вещества).
Для сферических частиц твердой фазы выражение (6) принимает вид:
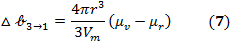
Потенциал 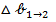 соответствует работе диспергирования. Поскольку при диспергировании не имеется агрегатное состояние и химический состав твердой макрофазы, работа диспергирования целиком определяется энергетическими затратами на образования новой поверхности:
соответствует работе диспергирования. Поскольку при диспергировании не имеется агрегатное состояние и химический состав твердой макрофазы, работа диспергирования целиком определяется энергетическими затратами на образования новой поверхности:
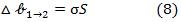
или, для сферических частиц
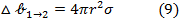
где  удельная свободная поверхностная энергия (поверхностное натяжения).
удельная свободная поверхностная энергия (поверхностное натяжения).
Тогда полное изменение энергии Гиббса при образовании зародыша (первичной частицы) конденсации с радиусом r составляет:

Из анализа уравнения (10) следует, что если  , то
, то 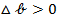 , т.е. новая фаза не может образоваться самопроизвольно. Условия самопроизвольного образовния зародышей новой фазы могут реализоваться в случае
, т.е. новая фаза не может образоваться самопроизвольно. Условия самопроизвольного образовния зародышей новой фазы могут реализоваться в случае 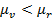 , что соответствует пересыщению жидкой макрофазой. Необходимость пересыщения для образования гетерогенной дисперсной системы из гомогенной следует из того факта, что появление избыточной поверхностной энергии при конденсации должно быть предварительно скомпенсировано избытком энергии Гиббса системы, что и обеспечивает пересыщенем.
, что соответствует пересыщению жидкой макрофазой. Необходимость пересыщения для образования гетерогенной дисперсной системы из гомогенной следует из того факта, что появление избыточной поверхностной энергии при конденсации должно быть предварительно скомпенсировано избытком энергии Гиббса системы, что и обеспечивает пересыщенем.
Степень пересыщения для пара и раствора выражается соотношениями:

где Р- давление пересыщенного пара;  - равновесное давление насыщенного пара над плоской поверхностью жидкости; С – концентрация вещества в пересыщенном растворе;
- равновесное давление насыщенного пара над плоской поверхностью жидкости; С – концентрация вещества в пересыщенном растворе; 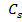 - равновесная растворимость относительно монокристалла.
- равновесная растворимость относительно монокристалла.
Для исследования зависимости энергии Гиббса образования зародыша от его размера r прировняем производную 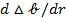 в уравнении (10) нулю и получим:
в уравнении (10) нулю и получим:
|
|
|

где 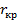 – критический радиус зародыша в эксперементальной точке.
– критический радиус зародыша в эксперементальной точке.
Выразив химические потенциалы жидкости (или кристалической фазы) и ее пара (или ее раствора) через соответствуещие давления пара (или конденсации раствора), получим:

где  - критическая степень пересыщения;
- критическая степень пересыщения;  и
и  - давление насыщенного пара над поверхностью зародыша и монокристалла соответственно
- давление насыщенного пара над поверхностью зародыша и монокристалла соответственно  - концентрация насыщенного раствора на поверхности зародыша и монокристалла.
- концентрация насыщенного раствора на поверхности зародыша и монокристалла.
Таким образом, условия экстремума энергетичной зависимости образования зародыша от его размера совпадает с уравнением Кельвина:

где  - давление насыщенного пара над искревленой и равной (с бесконечно большим радиусом кривизны) поверхностью соответственно.
- давление насыщенного пара над искревленой и равной (с бесконечно большим радиусом кривизны) поверхностью соответственно.
Из этого уравнения следует, что при положительно кривизне (например, для сферической часицы) давление насыщенного пара над искревленной поверхностью (над частицей) будет тем больше, чем больше кривизны, т.е. меньше радиус частицы.
При возниконовении зародыша конденсации давление пересыщенного пара  (критическое) в соответствие с уравнением (13) должно быть равно давлению насыщенного пара над поверхностью зародыша
(критическое) в соответствие с уравнением (13) должно быть равно давлению насыщенного пара над поверхностью зародыша  . Размер зародыша при этом условии называют критическим
. Размер зародыша при этом условии называют критическим 
Функция 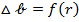 приходит через максимум. Это зависимость представлена на рис.2.
приходит через максимум. Это зависимость представлена на рис.2.
Максимум функции свидетельствует о неустойчивом равновесии (метестабильного состояние) между двумя фазами в данной точке. Если степень пересыщения γ меньше критической, то возникающие зародыши самопроизвольно испаряются (растворяютяс). Их размеры меньше критичекого, поэтому энергия Гиббса понижается с уменьшением размера зародыша. Пересыщенный раствор или пар в этих условиях удобно представить как гетерагенно – дисперсную систему, в которой присуствует множество постоянно образующихся и исчезающих зародыщей новой фазы. В критической точке неучтойчивость равновесия проявляется в том, что существует равная вероятность возникновения зародыщей конденсации.
Если степень пересыщения больше критической велечины, то возникоющие зародыши будут самопроизвольно расти. Энергия Гиббса (см. рис. 2) снижается с увелечением размеров зародышей в соответствие с уравнением Кельвина. Образование новых зародышей прекращается. Данное состояние системвы также являются неустойчивым, так как в системе происходят непрерывные процессы роста и исчезновения частиц дисперсной фазы: одна часть частиц растет за счет растворения (испарения) другой части частиц.
|
|
|

Рис.2. Зависимость энергии Гиббса образования зародыша от его радиуса
Критическая энергия Гиббса образования зародыщей конденсации соответствует максимум функции 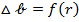 . Рассмотривая это состояние системы как неустойчивое равновесие, которому отвечает равненство химических потенциалов:
. Рассмотривая это состояние системы как неустойчивое равновесие, которому отвечает равненство химических потенциалов:

от уравнения (10) можно перейти к следующему:

или

Таким образом, энергия Гиббса образования зародыщей равна одной трити поверхностной энергии зародыша; остальные две трети от работы образования поверхности компенсируется химической состовляющей энергии, обусловленной энергетической выгодностью фазового перехода.
Подставляя в урвнение (17) значение радиуса из уравнения (13), получим:
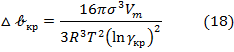
Из этого соотношения следует, что энергия образования зародыша конденсации зависит от степени пересыщения. Чем выше степень пересыщения, тем ниже энергия Гиббса образования зародыщей и тем меньше размеры образующихся зародыщей. 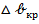 очень сильно зависит также от межфазного натяжения
очень сильно зависит также от межфазного натяжения 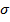 , которое можно снизить до очень малых значений за счет введения в систему различных по природе ПАВ. При малых значениях межфазного натяжения (десятые или сотые доли мДж/м²) обеспечивается самопроизвольное диспергирование (отрицательный знак приращения энергии Гиббсаобразования новой фаы). Обычно это наблюдается при образовании лиофильных дисперсных систем (в соответствии с уравнением (2)).
, которое можно снизить до очень малых значений за счет введения в систему различных по природе ПАВ. При малых значениях межфазного натяжения (десятые или сотые доли мДж/м²) обеспечивается самопроизвольное диспергирование (отрицательный знак приращения энергии Гиббсаобразования новой фаы). Обычно это наблюдается при образовании лиофильных дисперсных систем (в соответствии с уравнением (2)).
Параметры образующихся твердых зародыщей в жидкой фазе припереохлаждении можно оценить по уравнениям, приведенным для пересыщенного пара. Определение критического размера зародыша проводят по уравнению (12), предварительно записав разность химических потенциалов веществав твердом и жидком состояниях:

или
|
|
|
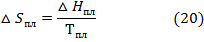
В таком случае уравнение (19) может быть переписано в виде:

где  - перещхлаждение.
- перещхлаждение.
Подставляя (21) в (12), получим:

т.е. чем больше переохлаждение, тем меньше размер критического зародыша.
Появления заряда в метастабильной систме также приводят к снижению энергии Гиббса образования зародышей. Это связано с тем, что в соответствии с известным урвнением Липпмана:

Поверхностное натяжение 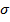 на границе раздела фазснижается с ростом электрического потенциала поверхности
на границе раздела фазснижается с ростом электрического потенциала поверхности  и тем сильнее, чем больше заряд поверхности
и тем сильнее, чем больше заряд поверхности 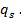 таким образом, зародыши, несущие на себе заряд, образуется при меньших степенях пересыщения – давление насыщенного пара над ними меньше получаемого по уравнению (13).
таким образом, зародыши, несущие на себе заряд, образуется при меньших степенях пересыщения – давление насыщенного пара над ними меньше получаемого по уравнению (13).
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 762; Нарушение авторских прав?; Мы поможем в написании вашей работы!