
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обнаружение гликогена и гранулезы
Обнаружение волютина
1. Фиксированный мазок окрасить метиленовым синим. Волютиновые зерна окрашиваются в интенсивно синий, цитозоль – в голубой цвет.
1. Приготовить препарат «раздавленная капля».
2. Окрасить раствором Люголя: гранулезу – стандартным; гликоген – более концентрированным.
Обнаружение жира
1. Каплю суспензии бактерий смешать с каплей 40-процентного формалина на предметном стекле.
2. Через 5 минут добавить каплю метиленового синего.
3. Через 10 минут добавить каплю судана III.
4. Микроскопировать под покровным стеклом. Цитоплазма приобретает синий цвет, капли жира – розовый.
Работа 21. Идентификация бактерий
- Составить карту свойств бактерий, выделенных в чистой культуре, по форме:
| Морфологические свойства | Культуральные свойства. Характеристика колоний. | Физиологические свойства | |||||||||||
| Форма, расположение, споры, капсулы. | Окраска по Граму, включения | Подвижность | Размер | Форма | Поверхность | Цвет | Край | Консистенция | Тип дыхания (по уколу в МПА) | Протеолитические свойства | Свертывание молока | Рост на картофеле | |
| Пузырьки газа на МПБ | Наличие желатиназы | ||||||||||||
- Провести идентификацию по Ленису. См. список литературы ().
- Сверить точность определения по Берги.
- Занести ход определения и характеристику вида в лабораторный журнал.
Тема 6. ИЗУЧЕНИЕ ВЕТВЯЩИХСЯ И ОБРАЗУЮЩИХ ПЛОДОВЫЕ ТЕЛА ФОРМ БАКТЕРИЙ МЕТОДОМ ЭЛЕКТИВНЫХ КУЛЬТУР
Работа 22. Миксобактерии
Оборудование: чашки Петри, колбы со стерильной дистиллированной водой, пипетка, пинцет, предметные стекла, спиртовка, петли, скальпель, препаровальные иглы, навозный агар, кроличий помет, однопроцентный раствор фуксина.
Ход работы
Закладка элективной культуры миксобактерий
- Вскипятить 10 г свежего кроличьего помета в 0,1 л водопроводной воды, профильтровать через ватный фильтр.
- К фильтрату добавить 0,5 г крахмала и 2 г агара. Разлить. Стерилизовать при 1 атм. 30 минут.
- Навозный агар разлить в чашки Петри, соблюдая стерильность, дать застыть,
- Заразить среду небольшим количеством кроличьего помета с помощью пинцета.
- Выращивать при t = 25-28°C в течение 14 дней, увлажняя помет дистиллированной водой, чтобы избежать развития плесневых грибов.
 |
Рис. 10. Плодовые тела и формы микроспор и вегетативных клеток некоторых миксобактерий
Изучение культуры
- Для изучения характера роста скальпелем вырезать кусочек агара с колониями, nepeнести на предметное стекло, микроскопировать при малом увеличении (рис. 10).
- Дли изучения морфологии клеток с колонии взять мазки, окрасить, микроскопмровать с иммерсионной системой, Под микроскопом видны палочковидные клетки и округлые микроцисты миксобактерий.
- Проследить цикл развития миксобактерий (рис 11). Зарисовать наблюдаемые формы.
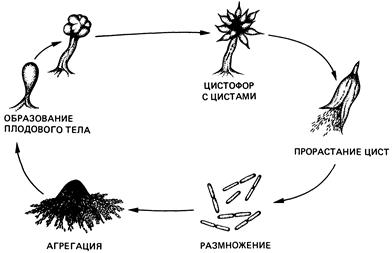
Рис. 11. Цикл развития миксобактерий
Работа 23. Микобактерии
Оборудование: спиртовка, петли, предметные стекла, кристаллизатор с подставкой, промывалка с водой, стерильный парафин, краситель (фуксин или генцианфиолет), стерильные конические колбы, гашетки. Для элективной минеральной среды: NН4 C1 - 0,05 г,К2НР04 - 0,05 г, MgSO4 - 0,02 г, СаСО3 - 0,02 г, воды- 100 мл, почва.
Ход работы
Закладка элективной культуры
1. Питательную среду стерилизовать при 1 атм. 20 минут, разлить в конические колбы слоем 1,5-2 см.
2. Пипеткой внести капли парафина, t
3. Заразить небольшим количеством почвы.
4. Выращивать в течение 2 недель при t = 28-30°С.
Изучение культуры
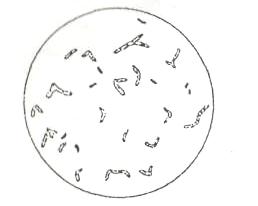
Рис. 12. Микобактреии
- Диск парафина, переворачивая, перенести на предметное стекло.
- Петлей снять с диска часть налета, приготовить мазок.
- Фиксируют, окрашивают, микроскопируют с иммерсионной системой, отмечая разнообразия форм клеток.
Работа 24. Актиномицеты
Оборудование: стерильные чашки Петри, предметные и покровные стекла, препаровальные иглы, скальпель, почва, сито, 70-80-процснтная уксусная кислота, голодный агар, 60-процентный этанол со следами аммиака, однопроцентный фуксии, промывали с водой.
Ход работы
Закладка элективной культуры
1. Разлить голодный агар в чашки Петри
2. С помощью сита равномерно рассеять мелкозем по поверхности агаровой пластинки. Наиболее благоприятна навеска до 20 мг.
3. Проращивать культуру при t = 25-28°С в течение 8-10 суток.
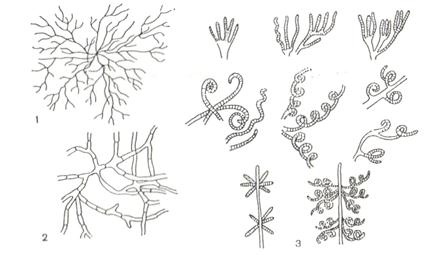
Рис. 13. Мицелии: актиномицета(1) и гриба (2); 3 – Формы спороносцев у актиномицетов
Изучение культуры
1. Вырезать блоки агара с колониями, перенести на предметное стекло.
2. Микроскопировать при малом увеличении. На препарате различается светлый воздушный и субстратный мицелий, гифы-спороносцы (рис. 13).
3. Для изучения процесса спорообразования изготовить препарат «отпечаток», пользуясь иммерсионной системой.
4. Зарисовать наблюдаемые формы.
Тема 7. ТРАНСФОРМАЦИЯ МИКРООРГАНИЗМАМИ СОЕДИНЕНИЙ АЗОТА
Работа 25. Аммонификация белка
Оборудование: весы, разновесы, колба 100-150 мл, дистиллированная вода, почва, водяная баня, электроплитка, спиртовка, петли, пинцет, предметные стекла, целлофан, резиновые колечки, чашки Петри, красная лакмусовая бумага, полоски фильтровальной бумлки, пропитанные 10-процентным раствором ацетата свинца, красители (фуксин, кристаллвиолетт), микроскоп, иммерсионное масло, пробирки с MПБ и МПА.
Ход работы
Закладкаэлективной культуры аэробных бактерий-аммонификаторон
1. Приготовить в колбе суспензию из 10 г почвы и 90 мл дистиллированной воды.
2. Расплавленный МПА охладить до 45-50°С и заразить одной петлей почвенной суспензии.
3. Содержимое перемешать и вылить в стерильную чашку Петри.
4. Инкубировать при t = 25-28°C в течение 3-4 суток.
Изучение культуры
1. Описать согласно схеме (работа 15) характерные колонии.
2. Приготовить постоянные препараты, микроскопировать с иммерсионной системой.
На МПА развиваются преимущественно колонии p. Bacillus, p. Pseudomonas, p. Proteus, p. Achromobacter.
Закладка элективной культуры анаэробных бактерип-аммопификаторов
1. Стерильный МПБ, разлитый высоким слоем в пробирки, заразить комочком почвы.
2. Под пробку прикрепить полоску лакмусовой бумаги для обнаружения аммиака и полоску бумаги, смоченной ацетатом свинца, для обнаружения сероводорода.
3. Пробирки закрыть ватными пробками и сверху закрепить целлофан с помощью резинового колечка (анаэробные условия).
4. Инкубировать при t = 25-28°С в течение 3-5 суток.
Изучение культуры
1. Отметить наличие аммиака и сероводорода (изменение цвета индикаторных бумажек).
2. Из нижних слоев жидкости выполнить мазок, приготовить постоянный препарат.
3. Микроскопировать с иммерсионной системой. Отметить наличие и расположение спор.
На мазках преимущественно выявляются бактерии р. Clostridium.
Закладка элективной культуры анаэробных бактерий-аммонификаторов
1. Стерильный МПБ, разлитый высоким слоем в пробирки, заразить комочком почвы.
2. Под пробку прикрепить полоску лакмусовой бумаги для обнаружения аммиака и полоску бумаги, смоченной ацетатом свинца, для обнаружения сероводорода.
3. Пробирки закрыть ватными пробками и сверху закрепить целлофан с помощью резинового колечка (анаэробные условия).
4. Инкубировать при t = 25-28ºС в течение 3-5 суток.
|
|
Дата добавления: 2014-12-17; Просмотров: 822; Нарушение авторских прав?; Мы поможем в написании вашей работы!