
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Активность и ионная сила электролита
Принятая теорией Дебая и Гюккеля.
Исходя из того, что сильные электролиты полностью диссоциированы, можно было ожидать, что коэффициент Вант-Гоффа i для электролита, диссоциирующего, например, на два иона, должен равняться двум не только в разбавленных, но и в достаточно концентрированных растворах. Однако опыты не подтверждают этого. Коэффициент i в растворах сильных электролитов в значительной степени зависит от концентрации электролита, уменьшаясь с увеличением концентрации раствора. Такая зависимость i от концентрации в растворах объясняется взаимодействием ионов между собой.
В электрическом поле постоянного тока ионы в растворах сильных электролитов имеют меньшую подвижность ввиду межионного взаимодействия.
Дело в том, что под влиянием внешнего электрического поля «ионная атмосфера» смещается к одному полюсу, а ион, находящийся в центре этой атмосферы, стремится к другому полюсу. Кроме того, увлекаемые ионами сольватные (гидратные) оболочки также способствуют их торможению. Чем выше концентрация растворов, тем плотнее «ионная атмосфера» и тем медленнее движутся ионы.
Межионное взаимодействие, а также сольватация ионов уменьшают не только абсолютную скорость их движения, но и осмотическое давление растворов, величину понижения давления пара над ними и т. д. Создается впечатление, что в растворе находится меньше ионов, чем на самом деле. Поэтому величина a является не истинной, а кажущейся степенью электролитической диссоциации сильного электролита.
В слабых электролитах, растворы которых содержат относительно малое количество ионов, взаимодействие последних сравнительно невелико. Кажущаяся степень диссоциации для них практически отвечает истинному значению.
В настоящее время все термодинамические расчеты свойств растворов сильных электролитов строятся на использовании введенной Льюисом величины активности электролита или активности его ионов. Активность определяется как величина, подстановка которой вместо концентрации в термодинамические уравнения делает их применимыми к рассматриваемым растворам.
Активности отличаются от концентраций только тем, что в них входят силы взаимодействия, существующие в растворах и не зависящие от природы растворенных частиц, а также от их концентрации. Поэтому активность можно представить как произведение концентрации на некоторый переменный фактор, называемый коэффициентом активности: a=fC.
где а — активность электролита (или его ионов), С — аналитическая концентрация электролита, f — коэффициент активности, включающий поправку на силы взаимодействия.
Коэффициенты активности можно найти, сравнивая аналитические, концентрации с теми величинами, которые следует подставить в уравнение для растворов электролитов, чтобы получить полное соответствие с опытными данными. Обычно их определяют экспериментальным путем по величине осмотического давления, по понижению температуры замерзания, по повышению температурь: кипения раствора или же путем измерения эдс, соответствующей гальванической цепи.
Коэффициент активности, как правило, бывает меньше единицы, лишь при очень большом разбавлении раствора, когда силы взаимодействия между ионами приближаются к нулю, коэффициент активности становится равным единице. В этом случае а» С, т. е. движение ионов в растворе не стеснено. У сильных электролитов, например, что имеет место только в очень разбавленных растворах при С << 0,0001 моль/л. В таких растворах расстояние между ионами достаточно большое, и межионные силы не оказывают влияния на скорость их передвижения.
Если коэффициент активности меньше единицы, активность ионов меньше их концентрации, получившейся при диссоциации растворенного вещества.
Необходимо отметить, что при очень больших концентрациях некоторых электролитов f вновь начинает расти, что объясняется недостатком молекул воды для гидратации всех ионов. Ионы, частично или полностью лишенные гидратной оболочки, особенно легко подвижны. Активность в подобных случаях оказывается выше действительной концентрации частиц, а коэффициент активности f становится больше единицы.
В водных растворах коэффициент активности данного электролита (или данного иона) зависит в основном от концентраций и валентностей всех присутствующих ионов. Коэффициент активности того или иного вещества может быть определен экспериментально различными методами. Необходимо отметить только, что величину коэффициентов активности отдельных ионов опытным путем определить нельзя, так как всегда результат получается итоговый для растворенного вещества в целом.
Для характеристики зависимости активности иона от концентрации всех находящихся в растворе ионов Льюис ввел понятие об ионной силе раствора электролита. Ионной силой раствора электролита называется величина (m), измеряемая полусуммой произведения концентрации (С ) каждого из присутствующих в растворе ионов на квадрат их валентности (z):
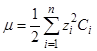
Недиссоциированные молекулы, как не имеющие зарядов, в формулу подсчета ионной силы раствора не включаются.
С увеличением концентрации раствора сильного электролита количество ионов в растворе возрастает, что приводит к увеличению ионной силы раствора и значительному уменьшению коэффициента активности, а следовательно, и активности всех ионов.
Для разбавленных растворов, ионная сила которых не превышает 0,01, коэффициент активности ионов связан с ионной силой раствора следующим соотношением:
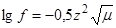
Из этой формулы следует, что чем больше ионная сила раствора, тем меньше коэффициент активности его ионов; если ионные силы двух растворов равны, то коэффициенты активности равновалентных ионов также одинаковы.
Поэтому при теоретических расчетах химических реакций в растворах в связи, например, с использованием закона действующих масс, необходимо брать не концентрации веществ, находящихся в растворе, а действующие активные массы исходных реагентов и образующихся продуктов реакции, которые в данный момент непосредственно участвуют в химическом процессе.
|
|
Дата добавления: 2014-12-17; Просмотров: 703; Нарушение авторских прав?; Мы поможем в написании вашей работы!