
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гальванические элементы
|
|
|
|
Если два различных металла погрузить в раствор электролита, то между ними возникает электрическое напряжение (разность потенциалов).Такая система
Металл 1 | Раствор электролита | Металл 2
называется гальваническим элементом, или гальванической цепью. Вместо металлов в гальванической цепи можно использовать и другие вещества с металлической проводимостью, например графит.
Возникновение разности потенциалов между обоими металлическими электродами объясняется различной склонностью металлов отдавать катионы в раствор электролита. У поверхности каждого из электродов возникает двойной электрический слой (см. рис. 1), который оказывает противодействие дальнейшему переходу катионов в раствор. Если оба металла соединить металлическим проводником,то вследствие электропроводности раствора электролита (ионной проводимости) получается замкнутая электрическая цепь (рис. 2).
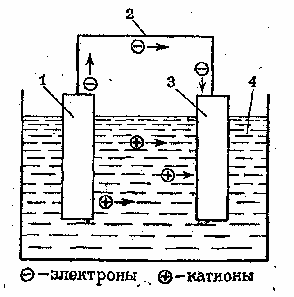
Рис. 2. Принципиальная схема гальванического элемента. 1 – неблагородный металл; 2 – проводник; благородный металл; раствор электролита.
В этой цепи поток электронов будет перемещаться от менее благородного металла через внешний участок цепи (металлический проводник) к более благородному металлу. При этом в растворе электролита катионы будут двигаться к благородному металлу и разряжаться под действием имеющихся на нем электронов. В результате в замкнутой гальванической цепи возникнет электрический ток.
Электрохимические процессы, лежащие в основе действия гальванических элементов, схематически можно представить так:
| Неблагородный металл | Благородный металл |
| Окисление | Восстановление |
| Отдача ее, образование катионов. | Прием ее, разрядка катионов |
Например: Гальванический элемент Даниэля — Якоби (рис. 3) состоит из цинкового электрода — цинковая пластина, погруженная в раствор сульфата цинка(II), и медного электрода — медная пластина, погруженная в раствор сульфата меди(II): Zn | ZnSO4 || СuSО4 | Сu.
|
|
|
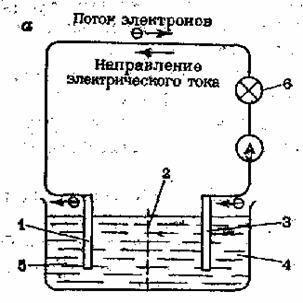
Рис. 3. Гальванический элемент Даниэля – Якоби. 1 – цинковая пластина; 2 – диафрагма; 3 – медная пластина; 4 – раствор CuSO4; 5 – раствор ZnSO4; 6 – лампа накаливания.
Таким образом, данный элемент представляет собой электрохимическую систему:
| Металл 1 | Раствор электролита 1 | Раствор электролита 2 | Металл 2 |
При замыкании цепи в этом элементе протекают следующие электродные процессы:
Zn0 -2е- = Zn2+ – (окисление); Сu2+ + 2е-— Сu0 – (восстановление) или суммарно (окислительно-восстановительная реакция): Zn0 + Сu2+ = Zn2+ + Сu0.
Каждый гальванический элемент состоит из двух электродов (окислительно-восстановительных пар), один из которых является поставщиком электронов, а другой их принимает. При этом на одном электроде возникает избыток электронов (в данном примере — на цинке), а на другом — недостаток электронов (на меди). Электрод с избытком электронов называют отрицательным полюсом гальванического элемента, или анодом, а электрод с недостатком электронов — положительным полюсом, или катодом (в элементе Даниэля — Якоби это соответственно цинковый и медный электроды).
|
|
|
|
|
Дата добавления: 2014-12-17; Просмотров: 599; Нарушение авторских прав?; Мы поможем в написании вашей работы!