
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Третье началоКТД известно как теорема Нернста [77,78], следствием которой является так называемый принцип недостижимости нуля абсолютной температуры. 7 страница
|
|
|
|
В классической термодинамике используются также второе и третье начала.
Второе начало КТД в математическом выражении имеет вид [ 77,78]:
δq = Tds. (4.2)
Физически соотношение (4.2) означает, что удельная внешняя теплота, подводимая к термодинамической системе или отводимая от нее, определяется изменением удельной энтропии ТДС. При этом утверждается, что в изолированных процессах ds = δg/T > 0.
Это неравенство отражает собой так называемый принцип возрастания энтропии. Второе начало КТД определяет направление протекания неравновесных процессов и «обеспечивает» установление условий равновесия ТДС. Однако если принять во внимание существование принципа эквивалентности теплоты и работы, то становится очевидным, что равенство (4.2) также является неполным.
Таковы основные законы и принципы классической термодинамики, все три начала которой, как показано в [ 77,79 ], оказались логически не связанными друг с другом. Иными словами, в построении классической термодинамики заложен эклектический принцип, который привел к тому, что она является, по существу, внутренне несогласованной наукой.
Являясь, по общему мнению макрофизической наукой, которая не рассматривает микроструктуру вещества и движение микрочастиц в нем, классическая термодинамика оперирует только независимыми переменными (так называемыми параметрами состояния термодинамической системы), определяющими вещество ТДС как целое. К параметрам состояния относятся удельная внутренняя энергия, давление, удельный объем, абсолютная температура, удельная энтропия, скорость звука и другие. Указанные параметры состояния ТДС могут быть определены экспериментально либо методами статистической физики.
|
|
|
Математический аппарат классической термодинамики, основанный на свойствах полного дифференциала, позволяет описывать изменения параметров состояния ТДС только в дифференциальной форме (форме бесконечно малых приращений). Примечательно, что в случае необходимости описания каких-либо процессов в полных параметрах, конечные выражения, содержащие полные параметры (объем, внутреннюю энергию, энтропию и т. д.), по форме не отличаются от подобных им выражений, записанных в удельных параметрах, хотя под знаком дифференциала оказывается и масса вещества ТДС.
Тем самым оказывается, что масса приобретает статус параметра состояния ТДС. В этом можно усмотреть противоречие с классической механикой, где масса тела всегда считается постоянной.
Интегрирование дифференциальных соотношений классической термодинамики требует наличия уравнения состояния вещества ТДС, которое обычно определяется опытным путем, либо методами статистической физики. В настоящее время известно более 150 уравнений состояний реальных ТДС, которые могут быть сведены к уравнению состояния реального газа, теоретически полученному Камерлинг-Оннесом методами статистической физики (77,78) в форме:
π = ρv = TαR = Tz, (4.3)
где π – удельная потенциальная энергия ТДС; ρ – давление; v –удельный объем; Т – абсолютная температура: α = f (ρ,T)– безразмерный параметр состояния ТДС, известный как фактор сжимаемости реальною газа; R = 8314/μ дж/кгк газовая постоянная; μ кг/моль – молекулярная масса вещества; z = αR.
Следует отметить, как весьма странное то обстоятельство, что ни в одном из известных уравнений состояния реальной ТДС не содержится такого параметра состояния, как удельная энтропия S. Параметр же z = αR = f (ρ,T), присутствующий в соотношении (4.3), до сих пор не нашел своего места в математическом аппарате КТД. Это лишний раз свидетельствует о действительно существующей внутренней несогласованности классической термодинамики.
|
|
|
Вместо соотношения (4.3) при проведении операций интегрирования различных соотношений КТД принято пользоваться уравнением состояния идеального газа в форме Клапейрона, которое легко может быть получено из (4.3) при α = 1 и имеет вид [ 77,78 ]:
αv = TR. (4.4)
Модель идеального газа, определяемая соотношением (4.4), настолько прочно утвердилась в современной науке, что фактически является доминирующей в таких важнейших теориях, как газовая динамика, теория турбулентности, химическая кинетика и др.
Между тем хорошо известно, что в Природе не существует веществ, обладающих свойствами идеального газа в достаточно широком диапазоне изменения давления и температуры. Поэтому не удивительно, что интегрирование точнейших соотношений классической термодинамики с использованием уравнения (4.4) приводит к приближенным, а часто — и к просто неверным результатам.
Следует отметить также, что наряду с уравнением состояния реального газа в форме (4.3) в классической термодинамике используют и уравнение состояния реального газа в форме Лапласа, которое широко применяется для определения квадрата скорости звука в любом однофазном веществе (твердом, жидком, паро- или газообразном) и является, таким образом, универсальным. Обычно это уравнение записывается в виде [ 77,78 ]:
π = w2 = γρv = (dp/dρ) s (4.5)
где π – удельная энергия ТДС в адиабатном волновом процессе; w – скорость звука; γ = сρ/cv = f(ρ,T) – безразмерный параметр ТДС, известный как показатель адиабаты процесса: сρ = f(ρ,T), cv = f(ρ,T) – удельные теплоемкости вещества при ρ = const и v = const', ρ = l/v – плотность вещества.
Как следует из литературы [ 53 ], соотношение (4.5) применяется для определения квадрата скорости звука в твердых телах (если γρ – модуль сдвига или модуль Юнга (для тонких стержней), в жидкостях (если γρ – модуль объемной упругости жидкости), в парах и газах (если; p – давление пара или газа).
С учетом уравнения (4.3) соотношение (4.5) принимает вид:
π = w2 = γpv = γTαR = γТz = (dp/dρ) s. (4.6)
Совершенно очевидно из сравнения соотношений (4.5) и (4.6), что (4.6) является более общим, так как содержит в себе уравнение (4.3). Поэтому, учитывая универсальность равенств (4.5) и (4.6), следует ожидать что уравнение (4.3) может быть использовано не только дня описания состояния реального газа или пара, но и для описания состояния жидких и твердых тел, то есть также может оказаться универсальным.
|
|
|
Принципиально важно указать на то, что равенство (4.5) было получено Лапласом в предположении, что распространение звука в веществе представляет собой волновой процесс, который происходит без обмена тепловой энергией между звуковой волной и окружающей средой. Подобные процессы получили в классической термодинамике название адиабатных.
Таким образом, факт наличия в равенствах (4.5), (4.6) или в каких-либо иных соотношениях термодинамики параметра γ следует считать указанием на то, что рассматриваемый процесс является физически подобным процессу распространения звука в веществе, т.е. является волновым и притом адиабатным.
Однако хорошо известно, что любой волновой процесс характеризуется взаимопревращаемостью кинетической и потенциальной энергий. Представив равенство (4.6) в виде [56]:
w2 = γpv = ypV/m = γTZ/m,
где V, m – объем и масса вещества термодинамической системы, находим:
mw2 = γpV = γТZ.
Отсюда следует ранее неизвестное соотношение:
2Е = γП, (4.7)
идентичное равенству (3.24'), полученному ранее в механике, где в общем случае Е = mw2 /2 + Jω2/2 – кинетическая, а П = pV= TZ – потенциальная энергия ТДС; J – момент инерции частицы; ω – угловая скорость ее вращения вокруг своей оси. При этом w2 = w2TP + w2r. Таким образом, очевидно, что параметр
γ = cp/cv = 2E/П = f (p,T), (С)
действительно служит количественной мерой взаимопревращаемости кинетической и потенциальной энергий в волновом адиабатном процессе распространения звука в веществе. Из физики [ 53, 57] известно, что отношение величин этих энергий определяет форму траектории тела (частицы) в пространстве, т.е. в данном случае — форму звуковой волны.
С учетом соотношения (4.7) закон сохранения полной энергии ТДС для волнового адиабатного процесса распространения звука в веществе принимает вид;
|
|
|
W = E ± П = (γ ± 2) П/ 2= (γ ± 2) E/γ = const, (4.8)
где знаки ± учитывают знак потенциальной энергии.
Зависимость γ = f (p,T),присутствующая в равенствах (4.5)÷(4.8), как очевидно, должна представлять собой периодическую функцию, изменяющуюся в пространстве и во времени. Однако из справочной литературы [80] этого явно не следует. В связи с этим определить истинную форму звуковой волны по справочным данным до сих пор не представлялось возможным.
Являясь наукой, описывающей процессы, происходящие (как очевидно) в пространстве и во времени, классическая термодинамика, тем не менее, не оперирует временем как параметром состояния ТДС. Между тем, ввести время в соотношения термодинамики не составляет особого труда. В самом деле, поскольку удельная потенциальная энергия ТДС эквивалентна удельной работе, производимой ТДС над окружающей средой, то с помощью уравнения (4.3) можно записать:
π = l = pv = Tz.
Используя это равенство, можно представить удельную работу в виде:
l = lt/t = Nt, (4.9)
где N – удельная мощность; t – время протекания процесса. В этом случае равенство (4.1) принимает вид:
du = Tds – pdv = Tds – Ndt. (4.10)
Однако даже такие простейшие временные преобразования, какими являются соотношения (4.9), до сих пор в классической термодинамике не применялись. Возвращаясь к равенству (4.1), следует указать, что на его основе, с помощью преобразований Лежандра [77] могут быть получены еще три так называемых характеристических уравнения классической термодинамики, являющихся выражениями полных дифференциалов:
удельной свободной энтальпии
dg = –sdT + vdp; (4.11)
удельной энтальпии
di = Tds + vdp; (4.12)
удельной свободной энергии
df = –sdT – pdv. (4.13)
Напомним о том, что преобразования Лежандра позволяют установить, является ли данное дифференциальное соотношение полным дифференциалом функции. Для того чтобы установить это в отношении, например, равенства (4.12), достаточно к обеим частям равенства (4.1) прибавить выражение полного дифференциала d (pv). В результате получим:
du +d (pv)= Tds – pdv + d (pv) = Tds + vdp.
Так как левая часть полученного выражения по свойству удельной внутренней энергии (как функции термодинамических параметров) заведомо является полным дифференциалом, то полным дифференциалом является и его правая часть. Поэтому, обозначая di = du + d (pv), в результате находим, что di = Tds + vdp. Аналогично могут быть получены и проверены соотношения (4.11)–(4.13).
Основываясь на известном из математики [77] необходимом и достаточном условии полного дифференциала (выраженным равенством накрест взятых частных производных), из соотношений (4.1), (4.11), (4.13) находим следующие дифференциальные соотношения классической термодинамики в частных производных, известные как уравнения Максвелла [77,78]:
(dT/dv) s = – (dp/ds) v, (4.14)
(ds/dp) T = – (dv/dT) p, (4.15)
(dT/dp)s = (dv/ds) p, (4.16)
(ds/dv) T = (dp/dT) v. (4.17)
Уравнения Максвелла широко используются в классической термодинамике для определения изменений параметров состояния термодинамической системы, позволяя сократить количество опытных данных о физических свойствах вещества, обнаружить возможные ошибки, возникающие в экспериментах или расчетах, заменить в уравнениях (при необходимости) одни параметры состояния другими.
Столь же важную роль в классической термодинамике играют и удельные теплоемкости [77,78]:
cp = T (ds/dT) p, (4.18)
cv = T (ds/dT) v. (4.19)
При этом оказывается справедливым равенство:
ср – cv = T (dp/dT) v (dv/dT) p. (4.20)
Используя, например, уравнение Клапейрона (4.4), с помощью равенства (4.20) можно получить известную формулу Майера для идеального газа:
cp – cv = R. (4.21)
Параметры состояния ТДС, которыми только и оперирует классическая термодинамика, являются среднестатистическими (т.е. вероятностными) величинами. Поэтому следует ожидать, что известная в КТД статистическая формула Больцмана для энтропии [78]:
S = kln (W), (4.22)
где k – постоянная Больцмана, W – отношение вероятностей состояния ТДС) может оказаться не единственной в ряду себе подобных. Формула (4.22), которая в классической термодинамике фактически не используется, позволяет осуществлять переход с макро- на микроуровень описания материи и служит, таким образом, своеобразным масштабным соотношением термодинамической теории.
В начале главы 4 упоминалось, что классическая термодинамика способна описывать процессы самой разнообразной физической и химической природы. Действительно, в некоторых работах по классической термодинамике изредка можно встретить уравнения, записанные в так называемом обобщенном виде. Например, в работе [77] дается обобщенная форма записи уравнений Максвелла (4.14)–(4.17). Это достигается тем, что обозначают у ≡ р, а х ≡ v. При этом у играет роль обобщенного потенциала, а х ≡ – обобщенной координаты.
Но если быть последовательным до конца, то необходимо признать, что в таком случае любые соотношения классической термодинамики могут быть представлены в обобщенном виде. Фактически это означает, что любые соотношения КТД могут быть использованы для описания не только тепловых, но и механических, электромагнитных и гравитационных взаимодействий.
К сожалению, автору до сих пор не приходилось встречать применения таких параметров, как энтропия и абсолютная температура ни в механике, ни в оптике, ни в электродинамике, ни в каких-либо других не термодинамических теориях. Изложенное подводит к выводу о том, что классическая термодинамика, являясь по существу универсальной теорией природных взаимодействий, используется не в полную силу, по-видимому, вследствие ряда спорных и противоречивых обстоятельств, часть из которых отмечена в ходе данного анализа. Принципиально важным из них является проблема универсального уравнения состояния ТДС. Именно поэтому указанная проблема должна быть исследована особо.
4.2. Универсальное уравнение состояния
вещества термодинамической системы
Отсутствие в классической термодинамике универсального уравнения состояния — ТДС вовсе не означает, что такого уравнения не существует. Результаты некоторых [81] новейших исследований (не выходящих, однако, за рамки привычных представлений КТД) указывают на то, что вероятность существования универсального уравнения состояния ТДС чрезвычайно высока. Попытаемся отыскать это уравнение. Для этого запишем уравнение состояния реального газа (4.3) в виде [82]:
π = pv = Tz, (4.23)
где π – удельная потенциальная энергия реального газа. Из соотношения (4.23) следует, что в общем виде
π = f1 (p,v) = f2 (Tz). (4.24)
Дифференцируя все части этого соотношения, находим:
 dπ = (dπ/dp) v dp + (dπ/dv) p dv = (dπ/dT)zdT + (dπ/dz)Тdz. (4.25)
dπ = (dπ/dp) v dp + (dπ/dv) p dv = (dπ/dT)zdT + (dπ/dz)Тdz. (4.25)
С другой стороны, дифференцируя все части равенства (4.23), получаем:
dπ = d(pv)= d(Tz) (4.26)
или
dπ = vdp + pdv = zdT + Tdz. (4.26a)
Сравнивая равенства (4.25) с (4.26а), находим коэффициенты:
v = (dπ/dp) v; p = (dπ/dv) p;
z = (dπ/dT) z; T = (dπ/dz) Т. (4.27)
Представим равенство (4.26а) в виде:
Tdz – pdv = –zdT + vdp. (4.28)
Важно определить, являются ли обе части этого выражения полными дифференциалами? Для этого воспользуемся преобразованиями Лежандра. Прибавляя к обеим частям (4.28) полные дифференциалы, выраженные равенством (4.26), находим тождество:
Tdz + vdp = Tdz + vdp. (4.29)
Применяя теперь к тождеству (4.29) необходимое и достаточное условие полного дифференциала, получаем:
(dT/dp) z = (dv/dz) p. (4.30)
С учетом равенств (4.27) для коэффициентов Т и v из (4.30) находим:
d/dpz ∙ (dπ/dz) Т = d/dzp∙(dπ/dp)γ,
откуда, заменяя индексы Т → р, v → z, получаем:
d2π/dpdz = d2π/dzdp.
Полученное выражение является известным математическим равенством. Поэтому можно заключить, что выражение (4.29), а следовательно и обе части выражения (4.28) являются полными дифференциалами. Применяя необходимое и достаточное условие полного дифференциала к обеим частям равенства (4.28), получаем:
(dT/dv) z = – (dp/dz) v, (4.31)
(dz/dp) T = – (dv/dT) p, (4.32)
Сравнивая уравнение (4.32) с уравнением Максвелла (4.15), находим [83]:
(ds/dp) Т = (dz/dp) Т = – (dv/dT) p.
Отсюда получаем:
(ds/dz) Т = ds/dz = 1.
Это означает, что dz – ds в процессе Т = const. Применяя вновь к соотношению (4.26а) преобразования Лежандра, вычитая из обеих его частей полные дифференциалы d (Tz) = d (pv), получаем тождество:
– zdT – pdv ≡ –zdT – pdv. (4.33)
Применяя к этому тождеству необходимое и достаточное условие полного дифференциала, получаем:
(dz/dv) T = (dp/dT) v. (4.34)
С учетом равенств (4.27) для z и р из равенства (4.34) получаем (заменяя индексы z → v, p → Т):
d/dvТ (dπ/dT) v = d/dTv∙ (dπ/dv) Т,
или
d2π/dvdT = d2π/dTdv.
Тем самым доказано, что выражение (4.33) также является полным дифференциалом.
Таким образом установлено, что все исследованные выражения (4.28), (4.29) и (4.33) являются полными дифференциалами. Необходимо, однако, доказать, что dz = ds не только в процессе Т = const, но и в процессах р = const и v = const.
Проще и нагляднее всего это можно сделать, если изобразить процесс Т = const в диаграмме T-S (рис. 56). Тогда расстояние между двумя точками 1, 2 на кривой Т = const дает равенство ∆z = ∆s. Если теперь через любую из точек, расположенных на кривой Т = const, провести кривые р = const и v = const, то для соответствующих точек 1, 2 на этих кривых также окажется, что ∆z = ∆s. Переходя к бесконечно малым, получим dz = ds.
Тот же результат можно получить, если сравнить полные дифференциалы:
du = Тds – pdv, (4.1)
di = Тds + vdp, (4.12)
du' = Тdz – pdv, (4.28)
di' = Тdz + vdp, (4.29)
где du', di' – просто обозначения полных дифференциалов (4.28), (4.29).
Из выражений (4.1), (4.28) для процесса v = const находим:
(du/ds) v = (du'/dz) v = Т.
Отсюда следует:
du/ds = du'/dz.
Подставляя в числители этого выражения соотношение (4.1), (4.28), получаем dz = ds.
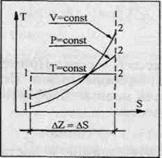
|
Рис. 56.
Аналогичным образом с помощью равенств (4.12), (4.29) можно показать, что в процессе р = const также dz = ds. Это свидетельствует о том, что dz = ds в любых термодинамических процес-сах. Поэтому, интегрируя равенство dz = ds в пределах 1 - 2 состояния ТДС, в каких-либо процессах (Т = const, p = const или v = const), находим с учетом обозначения z = Rα (где R – const):
z2 – z1 = s2 – s1 = R(α1 – α2). (4.35)
В графическом изображении (рис. 57) равенство (4.35) представляет собой уравнение прямых, проходящих в координатах z – α и s – α через начала координат и точки 1 и 2 под одинаковыми углами наклона φ = arctg(R) = const этих прямых к осям α. Общий вид уравнений этих прямых есть z = s = Rα.
С получением равенства z = S = Rα и с учетом уравнения (4.31), уравнение (4.23) принимает вид:
π = pv = Ts = Nt. (4.36)
Равенство (4.36) содержит пространственную (v)и временную (t)характеристики ТДС. В связи с этим излагаемая далее термодинамическая теория учитывает пространственно-временную сущность любых природных взаимодействий.

|
Рис. 57
Прежде чем будет определена действительная роль уравнения (4.36) в термодинамике, проведем дополнтельную проверку, смысл которой заключается в том, что если это уравнение не противоречит классической термодинамике, то с его помощью могут быть получены любые из известных в КТД соотношений. Для примера с помощью уравнения (4.36) выведем равенство (4.20):
cp – cv = T (dp/dT)v∙(dv/dT)p. (a)
Дифференцируя первые три части уравнения (4.36), получаем:
dπ = pdv + vdp = Tds + sdT. (b)
Дифференцируя все части уравнения (b) по Т, сначала при р = const, а затем при v = const, и вычитая почленно полученные результаты, с учетом равенств (4.18) и (4.19) находим
(dπ/dT) p – (dπ/dT) v = p (dv/dT) p – v (dp/dT) v = T [(ds/dT) p – (ds/dT) v ] = cp – cv. (c)
Применяя к выражению в квадратных скобках равенства (с) известную формулу математики [54]:
(dz/dx) u = (dz/dx) y + (dz/dy) x∙ (dy/dx) u
и полагая в ней z ≡ s, x ≡ Т, и ≡ р и у ≡ v, получаем:
(ds/dT) p – (ds/dT) v = (ds/dv) T (dv/dT) p. (d)
Заменяя в выражении (d) с помощью уравнения Максвелла (4.17)
(ds/dv)Т = (dp/dT)v
и подставляя полученный результат в соотношение (с), получаем формулу (а).
Используя теперь равенство (а), получим формулу Майера (4.21):
cp – cv= R (е)
Полагая s = const в уравнении рv = Ts, находим производные (dp/dT)v = s/v; (dv/dT)p = s/p, подставляя которые в равенство (а), получаем
(ср — cv)s = Ts/v∙s/p = s = αR.
Отсюда при α = 1 следует формула Майера (е) для идеального газа.
Итак, проверка показала, что уравнение pv = Ts не противоречит классической термодинамике. Более детальные исследования также подтверждают этот вывод. Следовательно, уравнение (4.36) может теперь на законных основаниях использоваться в дальнейших выкладках.
Прежде всего, определим роль параметра s = αR = f(p,T) в этом уравнении. Поскольку газовая постоянная R = 8314/ µ, [ Дж/кг∙К° ], где µ [ кг/моль ]— молекулярная масса вещества, то удельная энтропия
s = αR = α∙ 8314 /µ =f(p,T), [ Дж/кг∙К° ]
есть параметр состояния ТДС, который устанавливает взаимосвязь между физическими (α = f (p,T)) и химическими (µ) свойствами вещества термодинамической системы. В этом заключается одно из важнейших назначений удельной энтропии в термодинамике, чем и объясняется столь успешное ее применение в физической химии. С другой стороны, удельная энтропия соответствует удельной работе, производимой термодинамической системой над окружающей средой (либо окружающей средой над термодинамической системой) при изменении температуры на один градус, чем объясняется успешное применение термодинамики и в нехимических дисциплинах.
При анализе равенств (4.3), (4.5) и (4.6) было высказано предположение о том, что уравнение (4.3) может оказаться одинаково пригодным для описания состояния твердых, жидких, паро- или газообразных ТДС, то есть может оказаться в этом смысле универсальным.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 725; Нарушение авторских прав?; Мы поможем в написании вашей работы!