
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Специфичность действия
Кофакторы и коферменты
Трансаминазы, ЛДГ
Рихард Вильштеттер
30-е г.г. Джон Нортроп поставили точку в споре: ферменты- это белки!
Кристаллы химотрипсина быка
3. Согласно строению ферменты делятся на:
а) простые б) сложные
полностью белки состоят из 2-х компонентов
однокомпонентные 1) белкового (апофермента)
2) небелкового
например, рибонуклеаза (кофермента, простетическая
альдолаза, трипсин группа)
холофермент - весь активный
комплекс, состоящий из 1) и 2)
апофермент + кофермент↔холофермент
Тетрапиррольные / Металлы \ Производные
(цитохромы) (Са++,Mg++…) водорастворимых витаминов
(C, B1,В2, В12 …)

Mm ферментов, как у белков ~ 12000-1 млн Да
4. Свойства ферментов:
1) остаются неизменными после реакции
2) исключительная активность
В среднем 1 молекула фермента за 1 минуту при 37 градусах по Цельсию может превращать от 1000 до 1млн молекул субстрата
Ферменты ускоряют реакции, действуя в ничтожно малых концентрациях
· абсолютная специфичность- уреаза- действует на 1 субстрат
· относительная специфичность –эстеразы- на эфирную связь, пепсин- на пептидную связь
· стереоспецифичность- фермент выбирает в качестве субстрата один из изомеров, например, глицерокиназа- фосфорилирует глицерин, всегда синтезирует L-глицеролфосфат
4) способность катализировать как прямую, так и обратную реакции (обратимость ферментативных реакций) в зависимости от условий
5) термолабильность - чувствительность к температуре- предпосылка к управлению ходом химических реакций в организме, используется в кардиохирургии
6) ч увствительность к изменению рН среды
Каждый фермент- имеет оптимум рН. Для большинства ферментов это рН~6-7, а в кислой или щелочной среде их активность падает.
Исключения: пепсин- рН~1,5-2
Аргиназа -рН ~9,7-10

7) зависимость скорости реакции от времени

8) зависимость скорости реакции от концентрации фермента – выражается линейным отрезком до известного предела концентраций, затем- прирост скорости замедляется.

9) зависимость скорости ферментативной реакции от концентрации субстрата
Михаэлис и Ментен- изучали явление насыщения, разработали общую теорию ферментативной кинетики.
10) способность ферментов изменять активность в присутствии активаторов и ингибиторов
5. Единицы измерения активности фермента
Скорость реакции- измеряют количеством продукта, образовавшегося под действием фермента, или количеством исчезающего субстрата (за единицу времени).
МЕ- международная единица- количество фермента, катализирующего превращение 1 мкмоля субстрата в минуту (мкмоль/мин);
Катал(кат)- количество катализатора (фермента), способное превращать 1 моль субстрата в секунду)(моль/с).
Когда выразить количество фермента в весовых величинах нельзя- пользуются условными единицами активности ферментов (ЕА).
Удельная активность- мкмоль/мин/мг белка учитывает число ЕА, соотнесенное к массе белка в том же образце.
Молярная активность - количество молекул субстрата, превращенное одной молекулой фермента за 1 минуту
(число оборотов).
6. Классификация ферментов
1) Систематическая номенклатура.- Конец ХIХст.
Дюкло- предложил добавлять к названию субстрата
суффикс «аза»
Уреаза- гидролиз мочевины (от англ. «urea»)
Аргиназа
2) Тривиальная номенклатура - названия, не связанные с названием субстрата:
Пепсин, трипсин, тромбин.
3) Международная номенклатура- соглашение 1961г.- 6 классов в
зависимости от типа катализируемой реакции.
1 класс. ОКСИДОРЕДУКТАЗЫ
2 класс. ТРАНСФЕРАЗЫ
3 класс. ГИДРОЛАЗЫ
4 класс ЛИАЗЫ
5 класс ИЗОМЕРАЗЫ
6 класс ЛИГАЗЫ
Каждому ферменту- 4-значный шифр, например
ЛДГ – 1.1.1.27
1.- номер класса- оксидоредуктазы;
1.- подкласс- основные виды субстратов, участвующих в
данном типе химических превращений; ЛДГ действует
на СН-ОН-группу доноров;
1.- подподкласс-акцептором Н+ служит НАД или
НАДФ (у гидролаз эта цифра уточняет тип гидролизуемой
связи);
27.- порядковый номер- L-лактат:НАД-оксидоредуктаза.
АсАТ- 2.6.1.1
2.- класс трансферазы
2.6. –переносят азотистые группы
2.6.1- аминотрансферазы
2.6.1.1- L-аспартат:2-оксоглутарат-аминотрансфераза.
7. Понятие об изоферментах
ИЗОФЕРМЕНТЫ-различные молекулярные формы ферментов: обусловленные генетически или возникающие в результате посттрансляционной модификации.
Классическим примером изоферментов являются изоферменты ЛДГ
М М ЛДГ5
М М
М М ЛДГ4
М Н
М М ЛДГ3
Н Н
М Н ЛДГ2
Н Н
Н Н ЛДГ1
Н Н
Преобладают:
ЛДГ1, ЛДГ2- сердце, почки, эритроциты,головной мозг;
ЛДГ3 – яичники, лейкоциты, селезенка, лимфоузлы, эпителий, гладкая мускулатура кишечника,, мочеточники, матка, поджелудочная железа;
ЛДГ4,ЛДГ5- печень, скелетные мышцы, кожа.
Действуют на один и тот же субстрат, но отличаются по:
- по химической природе субъединиц, входящих в структуру
- электрофоретической подвижности
- адсорбционным свойствам
- оптимуму рН
- термостабильности
- чувствительности к ингибиторам
- сродству к субстрату и др.
Биологический смысл существования изоферментов
Клиническое значение
8. Понятие об активном центре фермента
АКТИВНЫЙ ЦЕНТР фермента- уникальная комбинация аминокислотных остатков в молекуле фермента, обеспечивающая непосредственное взаимодействие ее с молекулой субстрата (зона молекулы фермента, которая специфически взаимодействует с субстратом).
Э.Фишер: фермент и субстрат подходят друг к другу как ключ к замку.
Д.Кошланд: как рука и перчатка
В активном центре различают
а) каталитический участок, непосредственно вступающий в химическое взаимодействие с субстратом
б) связывающий участок- якорную площадку, которая обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом
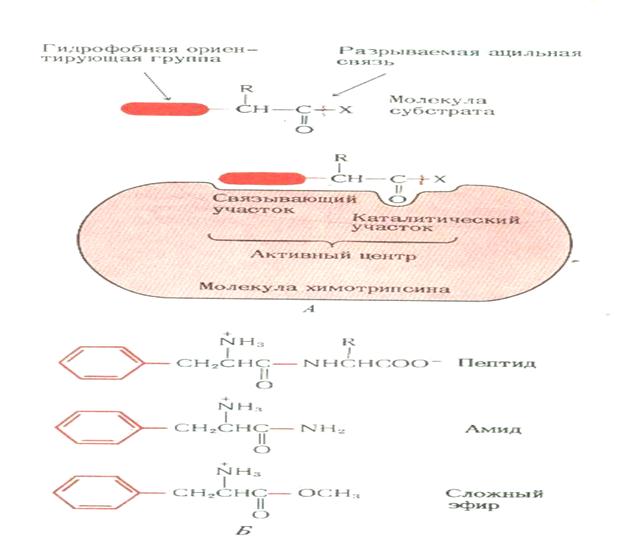
Активный центр химотрипсина
Помимо активного центра, в молекуле фермента
может присутствовать аллостерический центр
(от греч. Аллос-другой, иной, стереос-
пространственный, структурный)
Аллостерические (регуляторные) ферменты.
Аллостерические ферменты- это разновидность регуляторных ферментов, которые, помимо активного центра, имеют аллостерический (иной, другой) центр регуляции, с которым взаимодействуют аллостерические регуляторы (эффекторы, модуляторы) – активаторы или ингибиторы.
По своему молекулярному строению эти ферменты состоят из нескольких полипептидных цепей- имеют четвертичную структуру.
В их состав входят каталитический и регуляторный центры, которые находятся на разных белковых субъединицах.
Модификация каталитической активности такого фермента происходит путем передачи на каталитические субъединицы конформационных изменений с регуляторных субъединиц, где они происходят под влиянием эффекторов.
В состав активных центров разных ферментов входят радикалы определенных аминокислотных остатков: ОН-группы серина, треонина, тирозина; имидазольное кольцо гистидина; SH-группа цистеина, СООН-группы дикарбоновых аминокислот, NH3+ группы аргинина и лизина. В образовании активных центров принимают участие кофакторы данного фермента: простетические группы, ионы металлов.
Кривая зависимости скорости реакции от концентрации субстрата для этих ферментов имеет не форму гиперболы, а S-образную, что связано с кооперативными эффектами взаимодействия между субъединицами фермента.
9. М едицинская энзимология
4 направления
Энзимопатология
Энзимодиагностика
Энзимотерапия
Использование ферментов в качестве специфических химреактивов
|
|
Дата добавления: 2014-11-29; Просмотров: 525; Нарушение авторских прав?; Мы поможем в написании вашей работы!