
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 5. Строение атома. Периодическая система
5-1. Протон обозначается
| а) p | б) n | в) e | г) n |
5-2. Нейтрон обозначается
| а) p | б) n | в) e | г) n |
5-3. В состав атомного ядра входят
| а) протоны | б) нейтроны | в) электроны | г) фотоны |
5-4. Атом состоит из ядра и ___ оболочки.
| а) электронной | б) протонной | в) молекулярной | г) нейтронной |
5-5. Квантовые числа
| а) l | в) h | д) n |
| б) mS | г) l | е) j |
5-6. Уравнение Планка
| а) | 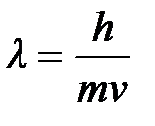
| б) | 
| в) | 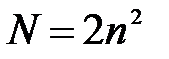
| г) | 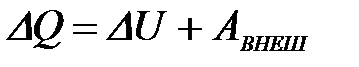
|
5-7. Верным является утверждение
а) масса протона приблизительно равна массе нейтрона и равна массе электрона
б) масса протона приблизительно равна массе нейтрона и во много раз больше массы электрона
в) масса протона равна массе электрона
г) масса нейтрона приблизительно равна массе электрона и во много раз меньше массы протона
5-8. Электрон имеет характеристики
а) масса = 1 заряд = 0
б) масса = 1 заряд = +1
в) масса = 1 заряд = –1
г) масса = 1/1840 заряд = 0
д) масса = 1/1840 заряд = –1
е) масса = 1/1840 заряд = +1
5-9. Число электронов в нейтральном атоме равно
| а) числу нейтронов в ядре | в) сумме числа протонов и нейтронов |
| б) числу протонов в ядре | г) массе атома |
5-10. Наибольшее число электронов на энергетическом уровне определяется выражением:
| а) | 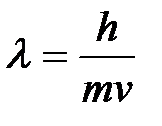
| б) | 
| в) | 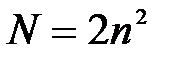
| г) | 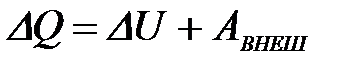
|
5-11. Главное квантовое число «n» характеризует
а) вращение электрона вокруг собственной оси и собственный магнитный момент движения электрона
б) ориентацию атомной орбитали в пространстве и ее магнитный момент
в) энергию электронного слоя (уровня), размер и плотность атомных орбиталей
г) форму атомной орбитали и орбитальный момент движения электрона
5-12. Орбитальное квантовое число «l» характеризует
а) вращение электрона вокруг собственной оси и собственный магнитный момент движения электрона
б) ориентацию атомной орбитали в пространстве и ее магнитный момент
в) энергию электронного слоя (уровня), размер и плотность атомных орбиталей
г) форму атомной орбитали
5-13. Магнитное квантовое число «ml» характеризует
а) вращение электрона вокруг собственной оси и собственный магнитный момент движения электрона
б) ориентацию атомной орбитали в пространстве
в) энергию электронного слоя (уровня), размер и плотность атомных орбиталей
г) форму атомной орбитали и орбитальный момент движения электрона
5-14. Спиновое квантовое число «mS» характеризует
а) вращение электрона вокруг собственной оси и собственный магнитный момент движения электрона
б) ориентацию атомной орбитали в пространстве и ее магнитный момент
в) энергию электронного слоя (уровня), размер и плотность атомных орбиталей
г) форму атомной орбитали и орбитальный момент движения электрона
5-15. Формулировка: «В атоме не может быть двух электронов, обладающих одинаковым набором квантовых чисел» соответствует
| а) принципу Паули | в) правилу Гунда |
| б) правилу Клечковского | г) принципу Гейзенберга |
5-16. Формулировка: «Суммарный спин электронов на подуровне должен быть наибольшим» соответствует
| а) принципу Паули | в) правилу Гунда |
| б) правилу Клечковского | г) принципу Гейзенберга |
5-17. Главное квантовое число принимает значения
| а) от –l через 0 до +l | в) +1/2 и –1/2 | д) 1, 2, 3,....¥ |
| б) от 0 до (n – 1) | г) 0, 1, 2, 3,....¥ |
5-18. Орбитальное квантовое число l принимает значения
| а) от –l через 0 до + l | в) +1/2 и –1/2 | д) 1, 2, 3,....¥ |
| б) от 0 до (n – 1) | г) 0, 1, 2, 3,....¥ |
5-19. Магнитное квантовое число принимает значения
| а) от –l через 0 до +l | в) +1/2 и –1/2 | д) 1, 2, 3,....¥ |
| б) от 0 до (n – 1) | г) 0, 1, 2, 3,....¥ |
5-20. Спиновое квантовое число принимает значения
| а) от –l через 0 до +l | в) +1/2 и –1/2 | д) 1, 2, 3,....¥ |
| б) от 0 до (n – 1) | г) 0, 1, 2, 3,....¥ |
5-21. Подуровню «s» соответствует значение орбитального квантового числа l (эль)
| а) 0 | б) 1 | в) 2 | г) 3 |
5-22. Подуровню «p» соответствует значение орбитального квантового числа l (эль)
| а) 0 | б) 1 | в) 2 | г) 3 |
5-23. Подуровню «d» соответствует значение орбитального квантового числа l (эль)
| а) 0 | б) 1 | в) 2 | г) 3 |
5-24. Подуровню «f» соответствует значение орбитального квантового числа l (эль)
| а) 0 | б) 1 | в) 2 | г) 3 |
5-25. Заполнению атомных орбиталей по правилу Паули соответствует электронно-графическая формула
| а) | б) ¯¯ | в) ¯¯ | г) ¯ |
5-26. Заполнению подуровня по правилу Гунда соответствует электронно-графическая формула
| а) |
| в) |
| ||||||
| б) |
| г) |
|
5-27. Подуровни третьего энергетического уровня
| а) p | б) d | в) s | г) f |
5-28. Соответствие между формулами и названиями
| 1) | 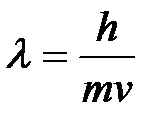
| а) | Уравнение Гейзенберга |
| 2) | 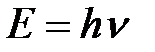
| б) | Уравнение Планка |
| в) | Принцип Паули | ||
| г) | Уравнение Эйнштейна | ||
| д) | Уравнение Де-Бройля |
5-29. Наибольшее число электронов, находящихся на атомной орбитали,
| а) 4 | б) 3 | в) 2 | г) 1 |
5-30. Могут существовать электронные конфигурации
| а) s3 | б) p4 | в) d14 | г) f6 |
5-31. Соответствие между обозначением подуровня и числом атомных орбиталей
| 1) | d | а) | |
| 2) | f | б) | |
| 3) | s | в) | |
| 4) | p | г) |
5-32. Последовательность заполнения атомных орбиталей по правилу Клечковского
| а) 1s 2s 2p 3s 3p 3d 4s 4p 5s 4d 5p... | в) 1s 2s 3s 4s 5s 2p 6s 3p 4p 5p 6p ... |
| б) 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p... | г) 1s 2s 2p 3s 3p 3d 4s 4d 4f 4p 5s 5p... |
5-33. Максимально возможное число электронов на уровне с главным квантовым число 4 равно
| а) 32 | б) 18 | в) 8 | г) 2 |
5-34. Количество орбиталей на подуровне связано с орбитальным квантовым числом соотношением
| а) n = l | б) n = l2 | в) n = 2 l | г) n = 2 l + 1 |
5-35. Соответствие между обозначением орбитального квантового числа и его значением
| 1) | d | а) | |
| 2) | s | б) | |
| 3) | f | в) | |
| 4) | p | г) | |
| д) |
5-36. Последовательность возрастания энергии атомных орбиталей
| а) 4s | б) 4p | в) 4d | г) 4f |
5-37. Электронная формула атома селена (порядковый номер 34)
| а) 1s2 2s2 2p6 3s2 3p6 3d7 4s2 4p6 | в) 1s2 2s2 2p6 3s2 3p6 4s1 3d5 4p4 |
| б) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4 | г) 1s2 2s2 2p6 3s2 3p6 4s2 3d6 4p0 |
5-38. Электронная формула атома кремния (порядковый номер 14)
| а) 1s22s22p63s23p2 | в) 1s22s22p43s23p5 |
| б) 1s22s22p63s13p4 | г) 1s22s22p63s33p2 |
5-39. Последовательность возрастания энергии подуровней
| а) 5s | б) 5p | в) 5d | г) 5f |
5-40. Элемент, электронная формула иона которого Э2– = [Ar3d10]4s24p6
(порядковый номер аргона 18), –
| а) селен | б) ванадий | в) фосфор | г) скандий |
5-41. Окончание электронной формулы...3d74s2 соответствует элементу
| а) галлию | б) железу | в) родию | г) кобальту |
5-42. Иону S–2 соответствует электронная формула
| а) 1s22s22p63s23p3 | в) 1s22s22p43s03p0 |
| б) 1s22s22p63s23p6 | г) 1s22s22p63s23p0 |
5-43. Периоды в периодической системе элементов расположены
| а) горизонтально | в) диагонально |
| б) вертикально | г) отсутствуют |
5-44. Группы в периодической системе элементов расположены
| а) горизонтально | в) диагонально |
| б) вертикально | г) отсутствуют |
5-45. Периоды в периодической системе элементов имеются
| а) большие | в) средние |
| б) малые | г) укороченные |
5-46. Группы в периодической системе делятся на ___ подгруппы
| а) большие и малые | в) главные и побочные |
| б) длинные и короткие | г) большие и побочные |
5-47. Периодически повторяется при увеличении зарядов ядер атомов
а) атомная масса элементов
б) радиус атомов химических элементов
в) строение электронных оболочек атомов
г) энергия ионизации
5-48. Номер периода в периодической системе
а) показывает сумму главного и орбитального квантового чисел
б) соответствует числу электронов во внешнем слое электронной оболочки
в) равен числу электронов на внешнем и предпоследнем слоях
г) равен числу электронных уровней, заполняемых электронами в атоме
5-49. Номер группы для элементов, расположенных в главных подгруппах, равен, как правило,
а) сумме s– и p–электронов внешнего слоя
б) сумме электронов, находящихся на s–орбиталях внешнего слоя и d–орбиталях предпоследнего слоя
в) числу заполненных s– и p–орбиталей внешнего слоя
г) сумме заполненных электронами орбиталей внешнего и предпоследнего электронного слоев
5-50. Свойства элементов повторяются периодически при увеличении зарядов ядер их атомов, потому что
а) периодически изменяется атомная масса элементов
б) нерегулярно изменяется радиус атомов химических элементов
в) периодически повторяется строение электронных оболочек атомов
г) периодически изменяется энергия ионизации
5-51. Энергией ионизации атома называется энергия,
а) выделяемая при присоединении электрона к атому
б) поглощаемая при присоединении электрона к атому
в) которую необходимо затратить для отрыва электрона от атома
г) которую необходимо затратить для разложения атома
5-52. Сродством к электрону называется энергия,
а) выделяемая при присоединении электрона к атому
б) поглощаемая при присоединении электрона к атому
в) которую необходимо затратить для отрыва электрона от атома
г) которую необходимо затратить для разложения атома
5-53. Одна из современных формулировок периодического закона Д.И.Менделеева: «Свойства элементов и их соединений находятся в периодической зависимости от....»
а) величины атомных масс элементов
б) строения электронной оболочки атомов
в) величины зарядов ядер их атомов
г) суммы числа протонов и нейтронов в атоме
5-54. Металлические свойства элементов по группе сверху вниз
| а) ослабевают | в) усиливаются |
| б) не изменяются | г) изменяются на неметаллические |
5-55. Типичные металлы находятся в
| а) начале каждого периода | в) середине каждого периода |
| б) конце каждого периода | г) верху каждого периода |
5-56. Свойства элементов по периоду (слева направо) изменяются от
а) металлических через амфотерные к неметаллическим
б) амфотерных через металлические к неметаллическим
в) неметаллических через амфотерные к металлическим
г) неметаллических через металлические к амфотерным
5-57. Элементы расположены по возрастанию энергии ионизации в паре
| а) литий и натрий | в) кислород и фтор |
| б) хлор и натрий | г) азот и мышьяк |
5-58. Элементы расположены по возрастанию радиуса атома в паре
| а) литий и натрий | в) кислород и фтор |
| б) хлор и натрий | г) мышьяк и азот |
5-59. Усиление металлических свойств происходит в паре
| а) кальций – бериллий | в) кальций – бром |
| б) кальций – калий | г) кальций – скандий |
5-60. Первый элемент обладает более сильными неметаллическими свойствами в паре
| а) кальций – бериллий | в) кальций – калий |
| б) кальций – скандий | г) кальций – бром |
5-61. Наибольшей электроотрицательностью обладает
| а) натрий | б) калий | в) сера | г) хлор |
5-62. Наибольший радиус атома имеет
| а) азот | б) литий | в) фтор | г) бериллий |
5-63. Радиус атома по группе для элементов главных подгрупп сверху вниз
| а) убывает | в) не изменяется |
| б) возрастает | г) изменяется периодически |
5-64. Элементы расположены в порядке возрастания электроотрицательности в ряду
| а) сера, натрий, калий, хлор | в) калий, натрий, хлор, сера |
| б) натрий, сера, калий, хлор | г) калий, натрий, сера, хлор |
5-65. Элементы расположены в порядке возрастания их радиуса в группе
| а) сера, натрий, калий, хлор | в) калий, натрий, хлор, сера |
| б) хлор, сера, натрий, калий | г) калий, натрий, сера, хлор |
5-66. Элемент, обладающий наибольшей электроотрицательностью,
| а) 1s22s22p63s23p | в) 1s22s22p63s23p0 |
| б) 1s22s22p63s23p1 | г) 1s22s22p63s23p5 |
5-67. Элемент, радиус атома которого наибольший,
| а) 1s22s22p63s23p3 | в) 1s22s22p63s23p0 |
| б) 1s22s22p63s23p1 | г) 1s22s22p63s23p5 |
5-68. Последовательность убывания энергии ионизации элементов
| а) 1s22s22p63s23p5 | в) 1s22s22p63s23p1 |
| б) 1s22s22p63s23p3 | г) 1s22s22p63s23p0 |
5-69. Элементы 3 периода заполняют электронами подуровни
| а) 3s и 4s | б) 3s и 3p | в) 3p и 3d | г) 3s и 3d |
5-70. Расположите элементы в порядке усиления металлических свойств
| а) 1s22s22p63s23p4 | в) 1s22s22p63s23p1 |
| б) 1s22s22p63s23p0 | г) 1s22s22p63s13p0 |
5-71. Расположите элементы в порядке усиления металлических свойств
| а) Э+2 = 1s22s22p63s03p0 | в) Э–3 = 1s22s22p63s23p6 |
| б) Э+3 = 1s22s22p63s03p0 | г) Э–1 = 1s22s22p63s23p6 |
_*_ _*_ _*_
5-72. Число неспаренных электронов в ионе Co+3, находящемся в основном состоянии, равно
| а) 6 | б) 5 | в) 4 | г) 2 |
5-73. Атомы изотопов одного элемента отличаются числом
| а) протонов | б) нейтронов | в) электронов | г) позитронов |
5-74. Атом углерода в основном состоянии содержит ___ неспаренных электрона(ов)
| а) 4 | б) 3 | в) 2 | г) 0 |
5-75. Оксид-иону соответствует электронная конфигурация
| а)1s22s22p5 | б) 1s22s22p6 | в) 1s22s22p4 | г) 1s22s22p0 |
5-76. Хлорид-иону соответствует электронная конфигурация
| 1) 1s22s22p63s23d6 | 2) 1s22s22p63s23p4 |
| 3) 1s22s22p63s23p6 | 4) 1s22s22p63s23d5 |
5-77. Ядро изотопа фосфора 15Р31 содержит ___ нейтронов
| а) 16 | б) 15 | в) 31 | г) 46 |
5-78. Относительная величина электроотрицательности элементов уменьшается в ряду
| а) P, Si, Al | б) Cl, I, Br | в) Se, S, O | г) B, C, N |
5-79. С кислотами и щелочами взаимодействует оксид
| а) лития | б) бериллия | в) магния | г) бора |
5-80. Среди галогенов наиболее сильным окислителем является
| а) фтор | б) хлор | в) бром | г) иод |
5-81. В ряду HF – HCl – HBr – HI сила кислот
| а) не изменяется | в) возрастает |
| б) изменяется неоднозначно | г) уменьшается |
5-82. Наиболее выраженными кислотными свойствами обладает водный раствор
| а) HCl | б) HI | в) HBr | г) HF |
5-83. Формула высшего оксида элемента, образующего водородное соединение ЭН2, имеет вид
| а) ЭО4 | б) ЭО3 | в) ЭО2 | г) ЭО |
5-84. Формула водородного соединения элемента, образующего высший оксид Э2О7, имеет вид
| а) H2Э | б) НЭ | в) ЭН4 | г) ЭН3 |
5-85. Элементы, находящиеся в одной группе и подгруппе, обладают одинаковым числом
| а) электронов | в) валентных электронов |
| б) протонов | г) энергетических уровней |
5-86. В группах с увеличением порядкового номера электроотрицательность элементов
| а) увеличивается | в) уменьшается |
| б) не изменяется | г) изменяется периодически |
5-87. Наиболее сильной кислотой является
| а) HClO3 | б) HClO4 | в) HClO | г) HClO2 |
5-88. В периоде с увеличением порядкового номера элементов металлические свойства
| а) ослабевают | в) не изменяются |
| б) усиливаются | г) изменятся периодически |
5-89. Радиус атомов уменьшается в ряду элементов
| а) Br, F, Cl | б) Se, S, O | в) Li, Na, K | г) P, Si, Al |
5-90. Кислотные свойства оксидов в ряду SO3 – SeO3 – TeO3
| а) изменяются неоднозначно | в) возрастают |
| б) убывают | г) не изменяются |
5-91. Кислотный характер имеют оксиды, образованные металлами
а) со степенью окисления равной или выше +4
б) со степенью окисления ниже +4
в) главных подгрупп
г) с любой степенью окисления
5-92. Для элементов одного периода характерно одинаковое число
| а) свободных электронных пар | в) валентных электронов |
| б) неспаренных электронов | г) энергетических уровней |
5-93. Формула водородного соединения элемента, образующего высший оксид Э2О5, имеет вид
| а) ЭН | б) ЭН3 | в) ЭН5 | г) ЭН2 |
5-94. На внешнем энергетическом уровне атома элемента, образующего высший гидроксид состава НЭО4, содержится ____ электронов.
| а) 4 | б) 7 | в) 5 | г) 6 |
5-95. Растворы щелочей реагируют с
| а) C | б) Mn | в) Zn | г) N2 |
5-96. Положительный заряд имеет
| 1) электрон | 3) протон |
| 2) анион | 4) позитрон |
5-97. Отрицательный заряд имеет
| 1) протон | 3) электрон |
| 2) нейтрон | 4) катион |
5-98. Кислотные свойства оксидов элементов в высшей степени окисления в периоде с увеличением порядкового номера
| 1) уменьшаются | 3) зависят от условий реакции |
| 2) не меняются | 4) увеличиваются |
|
|
Дата добавления: 2014-11-29; Просмотров: 613; Нарушение авторских прав?; Мы поможем в написании вашей работы!