
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы электролитов 2 страница
|
|
|
|
3(NH4)2S–2 + K2Cr2+6O7 + H2O = 3S0 + 2Cr+3(OH)3 + 2KOH + 6NH3

 S–2 – 2
S–2 – 2  = S0 3
= S0 3
Cr+6 + 6  = 2Cr+3 1
= 2Cr+3 1
Пример 4. Диоксид азота при растворении в воде образует смесь двух кислот. Напишите уравнение реакции.
Решение. Исходными веществами являются вода и диоксид азота NO2. Кислород и водород имеют в молекуле воды степени окисления (-2) и (+1), характерные и устойчивые для них. Следовательно, реакция происходит только за счет изменения степени окисления азота. В молекуле NO2 азот находится в промежуточной степени окисления (+4), он может и отдавать, и принимать электроны по схеме:
N+4 – 1  = N+5 – окисление,
= N+5 – окисление,
N+4 + 1  = N+3 – восстановление.
= N+3 – восстановление.
Поэтому при растворении NO2 в воде образуются азотная (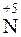 ) и азотистая (
) и азотистая (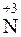 ) кислоты:
) кислоты:
2NO2 + H2O = HNO3 + HNO2.
Задания
151. Исходя из степени окисления хлора в соединениях HCl, HClO3, НСlO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
КВr + KВrO2 + H2SO4 ® Br2 + K2SO4 + Н2О.
152. Реакции выражаются схемами
P + HJO3 + H2O ® H3PO4 + HJ,
KMnO4 + KNO2 + H2SO4 = MnSO4 + KNO3 + K2SO4 + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
153. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях:
As3– ® As5+; N3++ ® N3–; S2– ® S°.
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
Na2SO3 + KMnO4+ Н2О ® Na2SO4 + MnO2 + KOH.
|
|
|
154. Исходя из степени окисления фосфора в соединениях РН3, Н3РО4, Н3РО3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициента в уравнении реакции, идущей по схеме
PbS + HNO3 ®S + Pb (NO3)2 + NO + H2O.
155. Реакции выражаются схемами.
P+ HNO3 + H2O ® H3PO4 + NO,
KMnO4 + Na2SO3 + KOH ® K2MnO4 + Na2SO4 + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
156. Составьте электронные уравнения и укажете, какой процесс – окисление или восстановление – происходит при следующих превращениях:
Мn6+ ®Мn2–; Cl5+ ® С1–; N3– ® N5+.
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
Сu2О + HNO3 ® Cu(NO3)2 + NO+ H2O.
157 Реакции выражаются схемами.
HNO3 + Ca ® NH4NO3 + Ca(NO3)2 = H2O,
K2S + KMnO4 + H2SO4 ® S + K2SO4 + MnSO4 + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
158. Исходя из степени окисления хрома, йода и серы в соединениях K2Cr2O7, КJ и H2SO3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
NaCrO2 + PbO2 + NaOH ® Na2CrO4 + Na2PbO2+ H2O.
159. Реакции выражаются схемами.
H2S + Cl2 + H2O ® H2SO4 + HCl,
K2Cr2O7 + H2S + H2SO4 ® S + Cr2(SO4)3 + K2SO4 + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
|
|
|
160. Реакции выражаются схемами.
KСlO3 + Na2SO3 ® КСl + Na2SO4,
KMnO4 + HBr ® Br2 + KBr + MnBr2 + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
161 Реакции выражаются схемами.
P + НlO3 + H2O ® H3PO4 + HCl,
H3AsO3 + KMnO4 + H2SO4 ® H3AsO4 + MnSO4 + K2SO4 + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
162. Реакции выражаются схемами.
NaCrO2 + Br2 + NaOH ®Na2CrO4 + NaBr + H2O,
FeS + HNО3 ® Fe (NO3)3 + S + NO + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
163. Реакции выражаются схемами.
HNO3 + Zn ® N2O+ Zn(NO3)2 + H2O,
FeSO4 + KCIO3 + H2SO4 ® Fe2 (SO4)3 + КСl + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
164. Реакции выражаются схемами.
К2Сг2O7 + HCl ® CI2 + CrCI3 + KC1 + H2O,
Au + HNO3 + HCl ® AuCI3 + NO + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
165. Могут ли происходить окислительно-восстановительные реакции между веществами: a) NH3 и КМnО4; б) HNO2 и HJ; в) НСl и H2Se? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
KMnO4 + KNO2 + H2SO4 ® MnSO4 + KNO3 + K2SO4 +H2O.
166. Реакции выражаются схемами.
HCl + CrO3 ® Cl2 + CrCl3 + H2O,
Cd + KMnO4 + H2SO4 ® CdSO4 + K2SO4 + MnSO4 + Н2О.
167. Реакции выражаются схемами.
J2 + NaOH ® NaOJ + NaJ,
MnSO4 + PbO2 + HNO3 ® HMnO4 + Pb (NO3)2 + PbSO4 + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
|
|
|
168. Реакции выражаются схемами.
H2SO3 + HC1O3 ® H2SO4 + HCl,
FeSO4 + K2Cr2O7 + H2SO4 ® Fe2 (SO4)3 + Cr2 (SO4)3 + K2SO4 + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
169. Реакции выражаются схемами.
J2 + Cl2 + H2O ®HJO3 + HCl,
FeCO3 + KMnO4 + H2SO4 ® Fe2(SO4)3 + CO2 + MnSO4 + K2SO4 + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
170. Могут ли происходить окислительно-восстановительные реакции между веществами: a) PH3 и НBr; б) K2Cr2O7 и Н3РО3; в) HNO3 и H2S? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
AsH3 + HNO3 ® H3AsO4 + NO2 + H2O.
1.9. Электродные потенциалы. Гальванические элементы
Пример 1. Увеличивается, уменьшается или остается без изменения масса никелевой пластинки, опущенной в растворы
Pb(NO3)2; ZnSO4; AgNO3; FeSO4; Al2(SO4)3; CuSO4?
Составьте молекулярные и электронные уравнения соответствующих реакций.
Решение. Чтобы ответить на вопрос, поставленный в условии задачи, необходимо знать значение стандартного электродного потенциала металла.
Стандартным (нормальным) электродным потенциалом металла называется скачок потенциала, возникающий на границе раздела фаз металл-раствор его соли с активной концентрацией ионов I моль-ион/л. Измеряется он по отношению к нормальному водородному электроду, величина потенциала которого условно принята равной нулю. Если расположить металлы в ряд по мере возрастания значений потенциалов, получится ряд напряжений металлов (ряд стандартных электродных потенциалов). Каждый металл вытесняет из растворов солей все металлы, стоящие за ним в ряду напряжений, т. е. менее активные.
Итак, никель (E0Ni2+/Ni = –0,23 В) будет вытеснять из растворов солей ионы свинца Pb2+(E0Pb2+/Pb = -0,13 В), меди Cu2+(E0Cu2+/Cu = 0,34 В) и серебра Ag+(E0Ag+/Ag = 0,80 В). Запишем уравнения реакций:
|
|
|
Ni + Pb(NO3)2 = Pb + Ni(NO3)2,
Ni0 – 2  = Ni2+,
= Ni2+,
Pb2+ + 2  = Pb;
= Pb;
Ni + CuSO4 = Cu + NiSO4,
Ni0 – 2  = Ni2+,
= Ni2+,
Cu2+ + 2  = Cu;
= Cu;
Ni + 2AgNO3 = 2Ag + Ni(NO3)2,
Ni0 – 2  = Ni2+,
= Ni2+,
2Ag+ + 2  = 2Ag.
= 2Ag.
Никелевая пластинка при этом частично растворяется, а восстановленный металл оседает на ее поверхности. Так как атомная масса никеля (58,7 а. е. м.) меньше, чем атомные массы свинца (207,2 а. е. м.), меди (63,5 а. е. м.) и серебра (107,8 а. е. м.), то масса никелевой пластинки увеличится.
В растворах солей железа, цинка и алюминия масса никелевой пластинки не изменится, так как никель не может вытеснить эти металлы из растворов их солей и реакция не пойдет.
Пример 2. Вычислите величину электродного потенциала кобальта в 0,001-молярном растворе его соли.
Решение. Значение электродного потенциала металла зависит от многих факторов – природы металла, температуры, концентрации соли и т. д. Эта зависимость выражается уравнением Нернста:
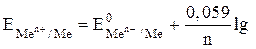 [Men+ × mH2O],
[Men+ × mH2O],
где EMen+/ Me – электродный потенциал металла; E0Men+/ Me – стандартный электродный потенциал металла; n - заряд иона металла в соли; [Men+ × mH2O] – активная концентрация ионов металла в растворе.
Рассчитаем значение электродного потенциала кобальта в 0,001-молярном растворе его соли. Величину стандартного электродного потенциала кобальта выписываем из ряда напряжений [I]:
ECo2+/ Co = E0Co2+/ Co + 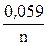 lg [Co2+ × mH2O],
lg [Co2+ × mH2O],
ECo2+/ Co = – 0,27 +  lg 0,001,
lg 0,001,
ECo2+/ Co = – 0,27 + 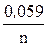 (–3),
(–3),
ECo2+/ Co = – 0,27 - 0,088,
ECo2+/ Co = – 0,358 В.
Пример 3. Составьте схемы двух гальванических элементов, в одном из которых кадмий будет анодом, в другом – катодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на электродах, и посчитайте электродвижущую силу (эдс) элементов.
Решение. Устройства, используемые для преобразования энергии химической реакции в электрическую, называются гальваническими элементами. Элемент работает за счет протекания окислительно-восстановительной реакции. Электрод, на котором идет восстановление, называется катодом, а окисление протекает на аноде. Если анод и катод изготовлены из разных металлов, то на электроде из более активного металла (с меньшим значением электродного потенциала) идет процесс окисления и он играет роль анода. Менее активный металл будет катодом и на нем протекает процесс восстановления.
Электродвижущая сила гальванического элемента равна разности значений электродных потенциалов катода и анода: ЭДС = EК - EА.
Чтобы в гальваническом элементе кадмий был катодом (E0Cd = – 0,40 В), в качестве анода нужно подобрать электрод из более активного металла, например, марганца (E0Mn = – 1,18 В).
Схема гальванического элемента:
(-)Mn ê Mn2+ êê Cd2+ ê Cd(+).
Уравнения реакций, протекающих на электродах:
на аноде (-) Mn0 – 2  = Mn2+ – окисление,
= Mn2+ – окисление,
на катоде (+) Cd2+ + 2  = Cd0 – восстановление,
= Cd0 – восстановление,
Mn0 + Cd2+ = Mn2+ + Cd0.
Рассчитаем ЭДС элемента по формуле
ЭДС = EК - EА = ECd - EMn = – 0,40 - (– 1,18) = 0,78 В.
Если в пару с кадмием в качестве другого электрода взять менее активный металл, например, свинец (E0Pb = – 0,13 В), то кадмий будет играть роль анода.
Схема гальванического элемента:
(-)Cd ê Cd2+ êê Pb2+ ê Pb(+).
Уравнения реакций протекающих на электродах:
на аноде (-) Cd0 – 2  = Cd2+ – окисление,
= Cd2+ – окисление,
на катоде (+) Pb2+ + 2  = Pb0 – восстановление.
= Pb0 – восстановление.
Рассчитаем ЭДС элемента по формуле
ЭДС = EК - EА = EPb - ECd = - 0,13 - (- 0,40) = 0,27 В.
Пример 4. Рассчитать ЭДС концентрационного гальванического элемента, в котором один медный электрод находится в 0,0001-молярном растворе соли меди, другой такой же электрод в 0,01-молярном растворе соли.
Решение. Если медные электроды опущены в раствор сульфата меди разной концентрации, то, поскольку значение электродного потенциала металла зависит от концентрации раствора соли, возникает разность потенциалов и появляется электродвижущая сила. Такой гальванический элемент работает за счет выравнивания концентрации соли и называется концентрационным.
Чтобы рассчитать ЭДС элемента, найдем значения электродных потенциалов меди в растворах разной концентрации:
ECu = E0Cu + 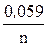 lg [Cu2+ × mH2O],
lg [Cu2+ × mH2O],
E1Cu = 0,34 + 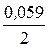 lg 0,0001 = 0,34 - 0,118 = 0,222 В,
lg 0,0001 = 0,34 - 0,118 = 0,222 В,
E2Cu = 0,34 +  lg 0,01 = 0,34 - 0,059 = 0,281 В,
lg 0,01 = 0,34 - 0,059 = 0,281 В,
E1Cu < E2Cu.
Медный электрод в 0,0001-молярном растворе соли будет анодом и на нем идет процесс окисления, а в 0,01-молярном растворе – катодом, на нем идет процесс восстановления:
на аноде (-) Cu0 – 2  = Cu2+ – окисление,
= Cu2+ – окисление,
на катоде (+) Cu2+ + 2  = Cu0 – восстановление.
= Cu0 – восстановление.
ЭДС = EК - EА = E2Cu - E1Cu = 0,281 - 0,222 = 0,059 В.
Задания
171. В два сосуда с голубым раствором медного купороса поместили в первый цинковую пластинку, а во второй серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярное уравнения соответствующей реакции.
172. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами a) CuSO4; б) MgSO4 в) Pb(NO3)2. Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
173. При какой концентрации ионов Zn2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала. Ответ: 0,30 моль/л.
174. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии её с растворами: a) AgNО3; б) ZnSO4; в) NiSO4. Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
175. Марганцевый электрод в растворе его соли имеет потенциал –1,23 В. Вычислите концентрацию ионов Мn2+ в моль/л. Ответ: 1,89×10–2 моль/л.
176. Потенциал серебряного электрода в растворе AgNO3 составил 95 % от величины его стандартного электродного потенциала. Чему равна концентрация ионов Ag+ в моль/л. Ответ: 0,20 моль/л.
177. Никелевый и кобальтовый электроды опущены соответственно в растворы Ni(NO3)2 и Со(NO3)2. В каком соотношении должна быть концентрация ионов этих металлов, чтобы потенциалы обоих электродов были одинаковыми? Ответ: [Ni2+]: [Co2+]» 0,117.
178. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
179. При какой концентрации ионов Сu2+ в моль/л значение потенциала медного электрода становится равным стандартному потенциалу водородного элемента? Ответ: 1,89×10–12 моль/л.
180. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите э.д.с. гальванического элемента, состоящего из серебряных электродов, опущенных первый в 0,01 н., а второй – в 0,1н. растворы AgNO3. Ответ: 0,058 В.
181. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите э.д.с. гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод – в 0,01 М растворе сульфата никеля. Ответ: 0,029 В.
182. Составьте схему, напишите электронные уравнения электродных процессов и вычислите э.д.с. гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Pb2+] = [Mg2+] = 0,0l моль/л. Изменится ли э.д.с. этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2,244 В.
183. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
184. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
185. Составьте схему, напишите электронные уравнения электродных процессов и вычислите э.д.с. гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Мg2+] = [Cd2+] = 1 моль/л. Изменится ли величина э.д.с., если концентрацию каждого из ионов понизить до 0,01 моль/л. Ответ: 1,967 В.
186. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ноны железа (в моль/л), чтобы э.д.с. элемента стала равной нулю, если [Zn2+] = 0,001 моль/л? Ответ: 7,3×10–15 моль/л.
187. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb (NO3)2 = Ni (NO3)2 + Pb.
Напишите электронные уравнения анодного и катодного процессов. Вычислите э.д.с. этого элемента, если [Ni2+] = 0,01 моль/л,
[Pb2+] = 0,0001моль/л. Ответ: 0.066 В.
188. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
189. Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора?
190. Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
1.10. Электролиз
Пример 1. Составьте электронные уравнения процессов, протекающих на электродах при электролизе раствора и расплава хлорида магния.
Решение. Электролизом называется окислительно-восстановительный процесс, протекающий на электродах при пропускании электрического тока через раствор или расплав электролита. Процесс электролиза показывают наглядно в виде схемы, которая учитывает диссоциацию электролита, окисление на аноде, восстановление на катоде и образующиеся продукты.
Напишем схему электролиза расплава хлорида магния:
MgCl2 D Mg2+ + 2Cl–,
катод (-); Mg2+; Mg2+ + 2  = Mg0 – восстановление,
= Mg0 – восстановление,
анод (+); 2Cl–; 2Cl– - 2  = Cl
= Cl  – окисление.
– окисление.
При электролизе водных растворов солей нужно учитывать и электролиз молекул воды. Так, на катоде можно ожидать восстановление не только катионов металла, но и ионов водорода по схеме:
1. Men+ + n  = Me0. (1)
= Me0. (1)
2. 2H+ + 2  = 2H0; 2H0 ® H
= 2H0; 2H0 ® H 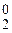 .
.
(2Н2О + 2  = Н
= Н 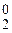 + 2ОН–) (2)
+ 2ОН–) (2)
Из этих конкурирующих процессов протекает тот, который выгоднее энергетически и для которого больше алгебраическое значение потенциала. Величина потенциала процесса восстановления ионов водорода в нейтральном растворе равна (– 0,41 В). По ряду напряжений металлы, стоящие за водородом, восстанавливаются легче, чем водород. Если значение потенциала металла намного меньше (– 0,41 В), на катоде восстанавливается водород. Это – металлы, стоящие в ряду напряжений от начала до алюминия включительно. Они из водных растворов не восстанавливаются. Если потенциал металла близок к
(– 0,41 В), то возможно одновременное протекание (1) и (2) процессов (по ряду напряжений - это металлы от алюминия до водорода).
На аноде, если имеется несколько конкурирующих процессов, окисление протекает в последовательности:
Анионы бескислородных кислот (кроме F), например,
An– - n  = А0.
= А0.
2. Электрохимическое окисление воды по схеме
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 701; Нарушение авторских прав?; Мы поможем в написании вашей работы!