
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные правила работы с термометрами 2 страница
|
|
|
|
Сущность такой перегонки заключается в пропускании струи пара через горячую смесь перегоняемого вещества и воды. Перегонка ведется при температуре кипения воды (100 оС). Пары воды захватывают с собой пары летучих продуктов, а поскольку они не смешиваются с водой, то легко отделяются от дистиллята. Такая перегонка применяется для отделения летучих органических веществ от смолистых веществ, которые образуются в ходе синтеза.
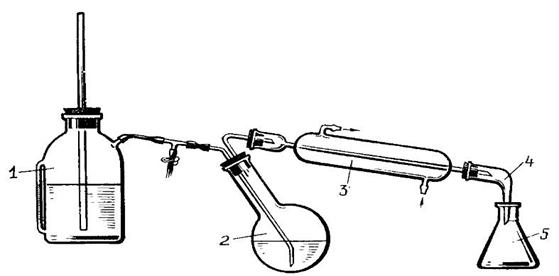
Установка для перегонки с водяным паром включает парообразователь 1, водоотделитель, перегонную колбу 2, холодильник 3, аллонж 4 и приемник 5.
19. ЭКСТРАКЦИЯ, ЦЕЛЬ, ВИДЫ. ВЫЩЕЛАЧИВАНИЕ.
ЗОННАЯ ПЛАВКА
Экстракция (экстрагирование) – метод извлечения из смеси каких-либо веществ одного или другого компонента с помощью растворителей. В основе метода лежит различная растворимость веществ в данном растворителе и различное распределение вещества между двумя несмешивающимися жидкостями.
Существуют два варианта проведения экстракции в зависимости от физического состояния экстрагируемого (извлекаемого) компонента:
1. Система «твердое-жидкость» - экстрагирование твердого вещества;
2. Система «жидкость-жидкость» - экстрагирование жидкостей.
В зависимости от применяемого растворителя различают экстракцию: водой или водными растворами; органическими растворителями; расплавами.
Растворитель может применяться холодным – холодное экстрагирование или горячим - горячее экстрагирование.
Экстрагирование твердых веществ.
Холодное экстрагирование водой или водными растворами называется выщелачиванием.
Наиболее распространенный растворитель-вода. Процесс проводят в стакане стеклянном или фарфоровом. Чем меньше растворяется вещество, тем больше должно быть отношение растворитель: твердое вещество (Ж:Т), чтобы больше извлечь за 1 прием. В лабораторных условиях можно составить батарею для выщелачивания. Извлекаемое вещество помещается в ряд стаканов. Растворитель заливается в первый стакан, после перемешивания, отстаивания и отделения от не растворившейся части, его заливают во второй стакан и т.д. Жидкость из последнего стакана сливают в приемник. Такое выщелачивание называется противоточным и позволяет получить более концентрированный раствор извлекаемого вещества.
|
|
|
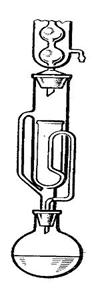
Экстрагирование органическими растворителями чаще всего осуществляют в специальных аппаратах – экстракторах Сокслета, включающих колбу и обратный холодильник. Экстрагируемое твердое вещество помещают в экстрактор в патроне или завернутым в фильтровальную бумагу. Экстагирующую жидкость заливают в колбу, и нагревают до кипения. Для обогрева колбу помещают в водяную баню, при этом в одну баню устанавливают сразу несколько аппаратов. Пары жидкости направляются в холодильник, там они конденсируются, конденсат стекает в экстрактор на экстрагируемое вещество, проходит через весь слой и далее через фильтровальную бумагу попадает обратно в колбу. После окончания опыта, раствор переносят в колбу Вюрца и отгоняют из него растворитель. Извлекаемое вещество остается в колбе.
 Экстрагирование жидкостей.
Экстрагирование жидкостей.
Экстрагирование в лабораторных условиях проводят в делительных воронках. Испытуемый раствор заливают в делительную воронку до половины, туда же добавляют (половину от взятого раствора) подходящий, не смешивающийся растворитель. Воронку закрывают и перемешивают многократным перевертыванием вверх-вниз. При энергичном встряхивании могут образовываться трудно разделимые стойкие эмульсии, на разрушение которых требуется длительное время, что нежелательно.
|
|
|
Затем воронку укрепляют на штативе и дают постоять некоторое время для полного расслоения, т.е. должна установиться четкая граница. Нижнюю часть медленно сливают в приемник. Иногда для более полного извлечения экстрагирование повторяют несколько раз. Затем растворитель отгоняют, и в перегонной колбе остается извлекаемое вещество.
Для экстрагирования из водных растворов применяют следующие растворители: диэтиловый эфир, петролейный эфир, бензин, бензол и т.п.
Если вещество, экстрагируемое из водного раствора, обладает хорошей растворимостью в воде, то во избежание расхода больших количеств растворителя экстракцию проводят следующим путем.
К водному раствору вещества добавляют чистую поваренную соль до образования насыщенного раствора. В концентрированных растворах солей растворимость других веществ, особенно органических, заметно понижается. Это позволяет добиться эффекта, применяя меньшие количества растворителя. Растворитель экономится и за счет понижения собственной растворимости в воде.
Лучше взять малые порции растворителя и провести многократную экстракцию, чем взять сразу большую порцию растворителя и провести экстракцию однократно. В первом случае экстракция будет более полной, а потери растворителя минимальными. При использовании тяжелых растворителей для перемешивания подают воздух или инертный газ.
Экстрагирование расплавами твердых органических веществ.
Для извлечения некоторых неорганических комплексов из водных растворов можно применять расплавы твердых органических веществ, имеющих низкую температуру плавления. Например, парафин (50оС), церезин (50оС), стеариновая кислота (70оС), нафталин (80оС), бензойная кислота (122оС).
В пробирку к горячему раствору добавляют расплавленное органическое вещество. Перемешав содержимое пробирки, охлаждают под струей холодной воды. Органическая застывшая масса с растворившимся в ней веществом останется на стенках пробирки, а жидкость сливается.
Застывшую массу разогревают и при необходимости реэкстрагируют другим горячим растворителем, а твердые экстрагирующие вещества используют повторно.
Зонная плавка – частный случай экстракции расплавленными веществами, когда твердая фаза находится в равновесии с жидкой фазой. Этот метод применим, если растворимость какой-либо примеси в жидкой фазе очищаемого вещества, отличается от растворимости в твердой фазе.
|
|
|
Особенно ценен этот способ для очистки органических веществ. которые имеют низкое давление паров и разлагаются при перегонке. Метод зонной плавки позволяет полностью использовать исходные вещества и получать большие монокристаллы органических веществ и некоторых металлов (алюминия, германия и др.). В простейшей форме метод зонной плавки в применении к металлам состоит в медленном перемещении расплавленной зоны вдоль стержня металла.
Для очистки органических веществ (например, бензойной кислоты) цилиндрический сосуд заполняют расплавленным веществом, после его затвердения, цилиндр пропускают через обогреваемое кольцо таким образом, чтобы расплавленная зона передвигалась вверх по цилиндру. Двукратная обработка бензойной кислоты методом зонной плавки заменяет 11 перекристаллизаций из бензола.
 Методом зонной плавки проводят очистку нафталина от антрацена. Загрязненный нафталин помещают в трубку из стекла пирекс длиной 900 мм и диаметром 25 мм. Эту трубку перемещают через небольшой цилиндрический нагреватель (может быть использована трубчатая печь).
Методом зонной плавки проводят очистку нафталина от антрацена. Загрязненный нафталин помещают в трубку из стекла пирекс длиной 900 мм и диаметром 25 мм. Эту трубку перемещают через небольшой цилиндрический нагреватель (может быть использована трубчатая печь).
На рисунке показана установка для зонной плавки органических веществ, состоящая из стеклянной жаропрочной трубки 1, в которую вставлена ампула 2. Электродвигатель 3 осуществляет движение ампулы, 4 - нагреватель.
Метод зонной плавки применяют и для очистки жидкостей. Для этого предварительно замораживают до минус 30оС бруски жидкости (например, с помощью смеси твердой углекислоты с ацетоном). Замороженную жидкость в лодочке протягивают через несколько последовательных зонных нагревателей. Расплавленные зоны, перемещаясь одна за другой, увлекают за собой примеси, имевшиеся в жидкости. Примеси концентрируются в конечной части бруска.
20. КРИСТАЛЛИЗАЦИЯ, ПЕРЕКРИСТАЛЛИЗАЦИЯ
Кристаллизация – осаждение кристаллов из горячего насыщенного раствора охлаждением. Кристаллы отфильтровывают, отжимают и сушат. Для быстрого охлаждения применяют холодную воду, снег или лед. Метод широко применяется для очистки как неорганических, так и органических веществ перекристаллизацией, которую повторяют несколько раз.
|
|
|
Метод основан на том явлении, что растворимость твердых веществ в горячих растворах намного выше, чем в холодных. Таким образом, если приготовить насыщенный горячий раствор соединений и дать ему остыть, он станет пересыщенным, что приведет к выпадению кристаллов.
Если в растворе присутствуют нерастворимые в горячем растворе примеси, то от них освобождаются путем фильтрования горячего раствора.
Если загрязняющие примеси перешли в горячий раствор, то при охлаждении, ввиду малых концентраций, пересыщения по примесям не будет, и они останутся в растворе. Кристаллы отфильтровывают, а примеси остаются в фильтрате - маточном растворе. Кристаллы высушивают.
Для получения абсолютной чистоты может потребоваться многократная перекристаллизация. Ключ к успешной кристаллизации лежит в использовании наилучшего растворителя, который легко растворяет вещество при нагревании, но в котором основной компонент почти не растворим при охлаждении. Для неорганических веществ самым распространенным растворителем является вода.
Выбор метода кристаллизации зависит от количества и природы образца и растворителя. При работе с неорганическими веществами кристаллизацию из водных растворов можно вести в термостойком стакане. Смесь вещества с водой нагревают до кипения, помешивая стеклянной палочкой. Полученный раствор охлаждают, выделившиеся кристаллы отфильтровывают на вороне Бюхнера, переносят в фарфоровую чашку и сушат в сушильном шкафу.
Для кристаллизации органических веществ наиболее распространены растворители с температурой кипения близкие к 60-90оС: бензин, петролейный эфир (смесь углеводородов), гексан, циклогексан, этилацетат, этанол, пропанол и ацетон.
При использовании органических растворителей кристаллизацию ведут в конической колбе, которая должна иметь шлиф для присоединения обратного холодильника. Размер колбы выбирают с учетом того, чтобы она была заполнена не более чем наполовину.
Взвешенное вещество через воронку загружают в колбу, туда же заливают небольшое количество растворителя и добавляют несколько гранул «кипятильничков». Присоединяют холодильник и начинают нагрев на водяной бане. Нагрев ведут до тех пор, пока не начнется равномерное кипение растворителя с конденсацией в обратном холодильнике. Спустя несколько минут, часть вещества должна раствориться. Через холодильник пипеткой добавляют растворитель небольшими порциями, пока все вещество не раствориться. Количество растворителя должно быть минимальным.
Если раствор содержит нерастворимый материал, например пыль или следы неорганического вещества, то его фильтруют в горячем виде. Если раствор окрашен смолистыми примесями, то примеси удаляют добавлением древесного угля. Для чего раствор остужают, добавляют 1-2% порошкообразного угля, затем раствор доводят до кипения и кипятят с обратным холодильником в течение нескольких минут. Древесный уголь абсорбирует примеси, а затем его удаляют горячим фильтрованием.
Наиболее эффективно вакуумное фильтрование через предварительно нагретую воронку, это позволяет избежать начала кристаллизации на воронке. Для фильтрации древесного угля, чтобы избежать засорения фильтровальной бумаги, рекомендуется использовать фильтровальный порошок – целит, который наносится на фильтровальную бумагу или добавляется непосредственно в раствор перед фильтрованием.
Прозрачный и слабо окрашенный раствор охлаждают до комнатной температуры и оставляют для кристаллизации. При медленном охлаждении образуются крупные кристаллы, при быстром – мелкие. При быстром охлаждении низкоплавкие вещества могут образовывать масла вместо кристаллов, что нежелательно, так как в маслах могут растворяться примеси и часть растворителя.
В этих случаях для получения кристаллов ведут медленное охлаждение, осторожно помешивая стеклянной палочкой. Способствует кристаллизации трение колбы стеклянной палочкой или добавка нескольких кристалликов «затравки».
После завершения кристаллизации кристаллы отделяют от холодного маточного раствора вакуумным фильтрованием.
Иногда при быстром росте кристаллических осадков происходит захват примесей из растворов – окклюзия. При окклюзии примеси поглощаются всей массой осадка. Это явление (соосаждение) является нежелательным, так как приводит к загрязнению осадка. Наиболее надежный способ уменьшения «окклюзированных» примесей - переосаждение или повторное осаждение.
Слипание частиц в дисперсных системах (особенно в коллоидных растворах) с образованием более или менее крупных агрегатов называется коагуляцией. Коагуляция также может привести к возникновению сплошной, хотя и рыхлой, пространственной структуры – коагуляционной структуры геля (коагеля).
Коагуляция может происходить самопроизвольно под влиянием химических или физических процессов, но чаще всего в результате внешнего воздействия (добавление электролита, поверхностно-активных веществ, электрофорез, повышение температуры, воздействие света и т.д.)
21. СПОСОБЫ ВЫСУШИВАНИЯ. ПРОКАЛИВАНИЕ
Высушивание - удаление остатков воды (обезвоживание), а также остатков органических растворителей. Высушивание необходимо в тех случаях, когда присутствие растворителей, в частности воды может привести к нежелательной побочной реакции или задерживать ход основной реакции.
Высушивание газов и жидкостей. Для высушивания часто применяют адсорбенты - твердые вещества с развитой поверхностью (например, оксид алюминия, силикагель, цеолиты), способные удерживать пары воды (адсорбционное поглощение воды). В этом случае вода с адсорбентом образует механическую смесь.
Так, для высушивания газов и паров их пропускают через слой адсорбента. Каждый адсорбент имеет предел насыщения, поэтому его необходимо периодически менять. Процесс проводят в поглотительных колонках или U-образных трубках.
Адсорбенты, по сравнению с другими высушивающими средствами, имеют следующие преимущества: они химически нейтральны, безопасны в обращении, не расплываются при насыщении водой, поглощают в обычных условиях влагу в количестве 12-30% от своей массы, легко регенерируются при нагревании, дешевы и достаточно доступны.
Химическое связывание воды применяется для высушивания газов, паров и жидкостей. Сущность метода заключается в том, что вода, присутствующая в высушиваемом образце, вступает в реакцию с третьим веществом (например, металлическим натрием, магнием или кальцием, карбидом кальция и др.).
Так как взаимодействие с водой представляет собой необратимую реакцию, поэтому высушивание по этому типу является более эффективным и часто применяется для окончательного обезвоживания, так называемого «абсолютирования» растворителей.
Наибольшей эффективностью в этой группе веществ обладает фосфорный ангидрид (Р2О5). Однако его нельзя применять при высушивании веществ основного характера, содержащих гидроксильные группы.
К высушивающим средствам с кислотными свойствами относятся - оксид бора (В2О3), с основными свойствами – оксид бария, оксид кальция.
Поглощение воды гигроскопическими веществами основано на способности некоторых веществ жадно поглощать воду или ее пары, образуя с ней кристаллизационные соединения (гидраты). Таким способом можно высушивать газы, жидкости и твердые вещества. Процесс проводят в закрытом сосуде (например, эксикаторе), при этом высушиваемое вещество размещают над гигроскопическим веществом, которое постепенно будет поглощать воду.
К высушивающим веществам с кислыми свойствами относится серная кислота. Применение серной кислоты для высушивания ограничивается ее агрессивностью по отношению ко многим органическим веществам.
Высушивание газов серной кислотой проводят в склянках Дрекселя, Тищенко, Вульфа и колонках различных типов. При высушивании воздуха серная кислота дает лучшие результаты, чем хлорид кальция, но значительно уступает фосфорному ангидриду и оксиду алюминия.
К высушивающим веществам с основными свойствами относятся едкое кали (КОН) и едкий натр (NaОН). Причем эффективность едкого кали в 60-80 раз выше, чем едкого натра. Особое значение эти вещества имеют для высушивания жидких органических оснований или их растворов.
Для высушивания применяют и нейтральные соли, которые образуют с водой гидраты: безводный перхлорат магния Mg(ClO4)2, перхлорат бария
Ba(ClO4)2, безводные сульфат магния, сульфат натрия, сульфат меди, сульфат кальция, хлорид кальция. Хлорид кальция является наиболее часто употребляемым высушивающим средством, как для газов, так и для жидкостей.
По уменьшению эффективности высушивающие средства можно расположить следующим образом: P2O5>Al2O3> B2O3>BaO>Mg(ClO4)2> KOH> H2SO4> Cиликагель> CaSO4> CaO>CaCl2> NaOH> CuSO4> MgSO4> Na2SO4.
Так при высушивании воздуха, насыщенного водяным паром, пропусканием через P2O5 остаточное содержание водяных паров при 25оС составило менее 0,000025 мг на 1 л воздуха, а через CuSO4 - 1,4 мг на 1 л воздуха.
Гигроскопические вещества (например, хлорид кальция) можно вводить непосредственно в жидкость, если они не взаимодействуют с высушиваемым веществом. Хлоридом кальция нельзя сушить спирты и амины. Для высушивания спиртов применяется безводный сульфат меди или оксид кальция. После такого высушивания жидкость фильтруют или перегоняют.
Осушители для различных классов органических соединений
| Классы органических соединений | Рекомендуемые осушители |
| Предельные, циклопарафиновые, этиленовые и ароматические углеводороды; простые эфиры | Хлористый кальций, сернокислый натрий, сернокислый магний, металлический натрий |
| Галогенопроизводные углеводородов | Хлористый кальций, сернокислый натрий, сернокислый магний, пятиокись фосфора |
| Спирты | Углекислый калий, сернокислый натрий, сернокислый магний, окись кальция, сульфат меди |
| Альдегиды | Сернокислый натрий, сернокислый магний |
| Кетоны | Сернокислый натрий, сернокислый магний |
| Амины и другие органические основания | Едкое кали и едкий натр, окись кальция, углекислый кальций |
| Карбоновые кислоты | Сернокислый натрий, сернокислый магний |
| Сложные эфиры | Сернокислый натрий, сернокислый магний |
Высушивание вымораживанием основано на свойстве воды при охлаждении образовывать кристаллы льда, которые отделяют сливанием жидкости или фильтрованием. Этим способом можно высушивать газы и жидкости.
Высушивание твердых веществ. Высушивание путем испарения воды при низких температурах применимо только для негигроскопических веществ, не выдерживающих нагревание. Для освобождения от растворителя вещество раскладывают тонким ровным слоем на фильтровальную бумагу, сложенную в несколько раз, покрывают сверху также листом фильтровальной бумаги и вручную отжимают вещество между листами бумаги. Окончательное удаление растворителя путем высушивания вещества на воздухе при комнатной температуре достигается лишь в течение нескольких часов (или даже 1—2 дней). Для этого отжатое вещество раскладывают тонким слоем на фильтровальной бумаге и покрывают (но не завертывают в пакет) другим листом фильтровальной бумаги для защиты от пыли. Ускорить высушивание можно слабым нагревом или легким движением воздуха, создаваемого вентилятором.
В некоторых случаях высушивание твердых веществ с высокой температурой плавления проводят нагреванием их в фарфоровой чашке на водяной бане.
Высушивание при нагревании (обычно 105-110оС) или испарение воды при нагревании наиболее распространенный способ для высушивания твердых веществ. В этом случае часто пользуются сушильными шкафами. Если желательно избежать нагревания, например, при высушивании веществ, разлагающихся при повышенной температуре, пользуются сушкой при пониженном давлении. При разрежении, создаваемом водоструйным насосом, и при температуре 15 - 25°С испарение воды осуществляется примерно с такой же скоростью, как при 100° С и атмосферном давлении.
Часто высушивание в вакууме сочетают с применением высушивающих средств, для чего служат вакуум-эксикаторы. В эксикаторах или вакуум-эксикаторах сушат также и гигроскопические органические вещества. В качестве водоотнимающего средства применяют хлорид кальция или фосфорный ангидрид.
При высушивании вещества в вакуум-эксикаторе с помощью водоструйного насоса создают минимальное разряжение, после чего кран вакуум-эксикатора закрывают, и лишь изредка и ненадолго включают насос, чтобы компенсировать недостаточную герметичность прибора. При работе с вакуум-эксикатором необходимо обернуть его полотенцем перед присоединением к водоструйному насосу. Вещества, содержащие трудно летучие растворители, например, ледяную уксусную кислоту или лигроин, перед высушиванием рекомендуется промыть легколетучим растворителем (эфиром, ацетоном, нефтяным эфиром).
Высушивание твердых веществ можно проводить органическими веществами (спирт, ацетон) при условии полной нерастворимости твердых веществ в жидкостях.
|
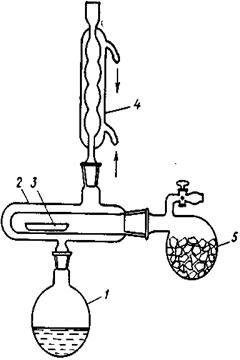
В приборе, который называется «пистолет Абдергальдена» (по другим источникам «пистолет Фишера»), может быть достигнуто наиболее полное отделение твердого вещества от растворителя, в том числе и от кристаллизационносвязанного растворителя, который в большинстве случаев не удаляется при высушивании вещества на воздухе или в вакуум-эксикаторе. Подлежащее осушке вещество помещается во внутреннюю трубку прибора. В реторту 5 помещают твердый поглотитель (например, Р2О5 — для удерживания воды, КОН — для удерживания уксусной кислоты и т. д.). Внутреннее пространство прибора вакуумируется с помощью водоструйного или масляного насоса. В колбу 1 наливают воду или другую негорючую жидкость и доводят ее до кипения. Пары этой жидкости, конденсирующейся внутри рубашки 2, обогревают трубку с веществом, что способствует полному и быстрому высушиванию.
Прокаливанием называют операцию нагревания твердых веществ до высокой температуры (выше 400оС). Целью прокаливания может быть:
· освобождение от летучих примесей,
· достижение постоянной массы,
· проведение реакций при высоких температурах,
· озоление после предварительного сжигания органических веществ.
Прокаливание проводят, как правило, в фарфоровых, кварцевых, платиновых или других тиглях, которые нагревают в печах (муфельных или тигельных). Тигли нагревают постепенно. Во избежание потерь при прокаливании тигли обычно закрывают крышками. При озолении сначала при слабом нагревании сжигают вещество, и уже после этого тигель закрывают крышкой.
Наиболее часто в лаборатории приходится прокаливать вещества с целью их обезвоживания, например CaCl2х6H2O, Na2SO4х10 H2O.
Прокаливание веществ с целью их обезвоживания можно вести на стальной сковородке, обогреваемой газом. Количество вещества должно быть небольшим, чтобы избежать потерь из-за возможного разложения.
В некоторых случаях прокаливание необходимо проводить в окислительной или восстановительной среде. Чаще всего для этого применяют трубчатые или специальные печи, через которые пропускают соответствующий газ их баллона. Для создания окислительной среды пропускают кислород, восстановительной – водород или оксид углерода. Нейтральную среду создают пропусканием аргона или азота.
Во избежание ожогов при нагревании и прокаливании никогда не следует брать голыми руками нагретые предметы колбы, стаканы, чашки, тигли и т.п. Нужно пользоваться полотенцем, напалечниками из резиновой трубки, специальными щипцами.
22. ВЫПАРИВАНИЕ. УПАРИВАНИЕ. ВОЗГОНКА
Операция удаления растворителя из растворов (водных и неводных) путем испарения с целью повышения концентрации – упаривание, а с целью выделения вещества – выпаривание.
Скорость испарения прямо пропорциональна поверхности испарения, поэтому процесс выпаривания проводят в фарфоровых, стеклянных или эмалированных чашках. Существенное влияние на процесс выпаривания оказывает температура, давление, перемешивание или циркуляция, а также толщина слоя жидкости. Более тонкие слои жидкости испаряются быстрее.
Если при высушивании удаляются остатки растворителя, то при упаривании и выпаривании берутся растворы веществ, в которых основным компонентом является растворитель.
Для упаривания хорошо использовать поверхностные инфракрасные испарители, которые не дают бурного кипения и обеспечивают равномерный нагрев. Процесс упаривания можно вести на песочной бане в стаканах, но не в конических колбах. Жидкость не должна занимать более 2/3 -3/4 его объема. Упариваемый раствор следует иногда перемешивать стеклянной палочкой. Если при упаривании следует повысить концентрацию раствора, то предварительно необходимо подсчитать, до какого объема нужно упарить жидкость.
В тех случаях, когда растворенное вещество разлагается при нагревании, растворитель удаляют под вакуумом, или применяя пленочное испарение. С увеличением разряжения температура кипения понижается и можно добиться того, что жидкость будет кипеть даже при комнатной температуре.
Сущность пленочного испарения заключается в том, что на стенке сосуда-испарителя образуют пленку раствора, что увеличивает поверхность испарения. Пленочное испарение можно проводить в сочетании с
созданием вакуума при низкой температуре. Пленочные испарители бывают вертикальные или горизонтальные. Горизонтальные в свою очередь бывают постоянно вращающиеся.
Если при открытом выпаривании в выпарительной чашке вещество «ползет» по стенкам чашки, то для предотвращения этого необходимо обеспечить равномерность нагрева. Для предотвращения «ползучести» при выпаривании берут две фарфоровые чашки и ставят одну в другую. Причем внутренняя чашка должна быть меньше диаметром и более плоской.
Если высокая температура может привести к разложению вещества, выпаривание проводят под уменьшенным давлением. Процесс ведут в установке, которая состоит из закрываемой колпаком чашки, соединенной через холодильник и сборник с вакуум-насосом. Выпаривание органических жидкостей надо вести беспламенным способом.
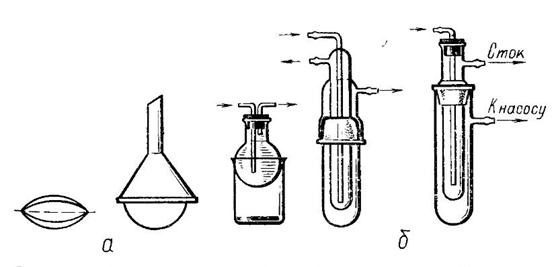
Возгонка или сублимация – превращение твердого вещества в пар, минуя жидкое состояние. Возгонку применяют для очистки твердых веществ, характеризующихся высоким давлением пара, например иода, серы, нафталина, бензойной кислоты, некоторых солей аммония. Процесс можно вести при обычном или уменьшенном давлении. На рисунке изображены приборы для возгонки под обычным давлением (а) и под уменьшенным давлением (б).
При нагревании возгоняемое вещество будет кристаллизоваться на часовом стекле, стенках воронки или охлаждаемых сосудов.
23. ТЕХНИКА ПРИГОТОВЛЕНИЯ РАСТВОРОВ. ПЕРЕМЕШИВАНИЕ. СИНТЕЗ ВЕЩЕСТВ
В лабораторной практике часто приходиться готовить растворы. Растворы подразделяются на истинные растворы и грубодисперсные (эмульсии, суспензии). Истинные растворы – растворы, в которых частички растворенного вещества не могут быть обнаружены оптическим путем. Размер частичек в истинных растворах меньше 10-7 см. Суспензии – дисперсные системы, в которых дисперсная фаза является твердой, а дисперсионная среда жидкостью (например, мутная глинистая вода). Эмульсия – жидкость, в которой во взвешенном состоянии находятся микроскопические частицы другой жидкости (например, молоко, где капельки жира распределены в воде).
Коллоидные растворы занимают промежуточное положение между истинными растворами и грубодисперсными. Размеры коллоидных частиц от 10-5 до 10-7 см.
В лабораторной практике обычно применяют истинные растворы. Широко используются кислоты разной концентрации. Для приготовления растворов кислоту необходимо приливать тонкой струйкой к воде при непрерывном перемешивании.
При приготовлении растворов из твердых веществ, их предварительно следует измельчить в ступке, а затем отвесить необходимое количество. Однако, если вещество гигроскопично (легко поглощает воду), то его растворяют не измельчая. Если при растворении порошки всплывают, их предварительно смачивают небольшим количеством спирта, а затем добавляют растворитель.
Растворять твердые щелочи следует путем медленного прибавления их небольшими порциями к воде при непрерывном перемешивании. Брать руками щелочь запрещается, для этого нужно использовать фарфоровые ложечки, лопатки или бумажные совочки, кусочки можно брать пинцетом.
По характеру взятого растворителя различают растворы водные и неводные. Растворы большинства солей, щелочей и кислот готовятся водными.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1739; Нарушение авторских прав?; Мы поможем в написании вашей работы!