
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронная структура атомов и периодическая система элементов
|
|
|
|
Задачи
4.1. Найти простейшую формулу соединения, содержащего (по массе) 43,4% натрия, 11,3% углерода и 45,3% кислорода.
4.2. Найти простейшую формулу вещества, в состав которого входят водород, углерод, кислород и азот в соотношении масс 1:3:4:7.
4.3. Найти простейшую формулу оксида ванадия, зная, что 2,73 г оксида содержат 1,53 г металла.
4.4. Вещество содержит по массе 26,53% калия, 35,37% хрома и 38,10% кислорода. Найти его простейшую формулу.
4.5. При взрыве смеси, полученной из 1 объема некоторого газа и 2 объемов кислорода, образуется 2 объема  и 1 объем
и 1 объем  . Найти молекулярную формулу газа.
. Найти молекулярную формулу газа.
4.6. Вычислить массу азота, содержащегося в 1 кг калийной селитры 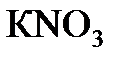 , аммиачной селитры
, аммиачной селитры 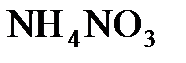 и аммофоса
и аммофоса 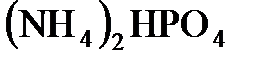 .
.
4.7. К раствору, содержащему 10 г  , прибавили 9 г
, прибавили 9 г 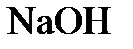 . Какое из веществ останется после реакции в избытке?
. Какое из веществ останется после реакции в избытке?
4.8. Раствор, содержащий 34,0 г  , смешивают с раствором, содержащим такую же массу
, смешивают с раствором, содержащим такую же массу  . Весь ли нитрат серебра вступит и реакцию? Сколько граммов
. Весь ли нитрат серебра вступит и реакцию? Сколько граммов  получилось в результате реакции?
получилось в результате реакции?
4.9. К раствору, содержащему 0,20 моля  , прибавили 0,24 моля
, прибавили 0,24 моля  . Сколько молей
. Сколько молей  образовалось в результате реакции и сколько молей
образовалось в результате реакции и сколько молей  осталось в растворе?
осталось в растворе?
4.10. Сколько граммов  можно получить из 265 г
можно получить из 265 г 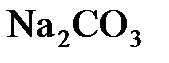 ?
?
4.11. Смешано 7,3 г  с 4,0 г
с 4,0 г 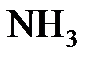 . Сколько граммов
. Сколько граммов 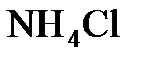 образуется? Найти массу оставшегося после реакции газа.
образуется? Найти массу оставшегося после реакции газа.
4.12. К раствору, содержащему 6,8 г  , прилили раствор, содержащий 5,0 г
, прилили раствор, содержащий 5,0 г  . Найти массу образовавшегося осадка.
. Найти массу образовавшегося осадка.
4.13. При разложении 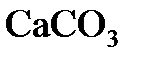 выделилось 11.2 л
выделилось 11.2 л  . Чему равна масса
. Чему равна масса 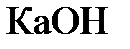 , необходимая для связывания выделившегося газа в карбонат?
, необходимая для связывания выделившегося газа в карбонат?
4.14. Вычислить отношение масс элементов в оксиде железа  .
.
4.15. Вычислить массовые доли (в %) элементов в оксиде меди  .
.
4.16. Вывести формулу соединения, в котором массовые доли составляют: 1,58% водорода, 22,22% азота и 76,20% кислорода.
|
|
|
4.17. Соединение состоит из 42,07% натрия, 18,91% фосфора и 39,02% кислорода. Вывести его формулу.
4.18. Массовые доли магния, фосфора и кислорода в соли соответственно составляют 21,83, 27,85 и 50,32%. Вывести формулу соли.
4.19. При обезвоживании 4,3 г кристаллической соды 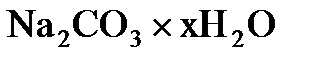 осталось 1,6 г вещества. Вывести формулу кристаллогидрата.
осталось 1,6 г вещества. Вывести формулу кристаллогидрата.
4.20. При соединении 6,2 г фосфора с кислородом получено 5,19 г оксида фосфора. Вывести его формулу.
Как было установлено в первой половине XX века, состояние электрона в атоме (его энергии, форма, размер и ориентация орбиты при движении вокруг ядра, а также вращение электрона вокруг собственной оси) характеризуются определенными значениями четырех квантовых чисел – 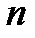 ,
,  ,
, 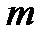 и
и 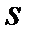 .
.
Главное квантовое число  , принимающее целочисленные значения 1, 2, 3, и т.д., «задает» (квантует) энергию электрона в атоме (Е~
, принимающее целочисленные значения 1, 2, 3, и т.д., «задает» (квантует) энергию электрона в атоме (Е~  ) и размер электронного облака: с ростом
) и размер электронного облака: с ростом 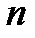 обе названные характеристики увеличиваются. Состояние электрона с определенным значением главного квантового числа называют энергетическим уровнем. При этом различают первый энергетический уровень (
обе названные характеристики увеличиваются. Состояние электрона с определенным значением главного квантового числа называют энергетическим уровнем. При этом различают первый энергетический уровень ( 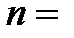 1), второй (
1), второй ( 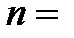 2) и т.д. Электроны, отвечающие одинаковым значениям
2) и т.д. Электроны, отвечающие одинаковым значениям 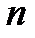 , образуют электронные облака примерно одинаковых размеров, которые принято называть электронными слоями, или электронными оболочками. В зависимости от величины
, образуют электронные облака примерно одинаковых размеров, которые принято называть электронными слоями, или электронными оболочками. В зависимости от величины  (1, 2, 3, 4, 5, 6, 7) различают слои (или оболочки), обозначаемые буквами
(1, 2, 3, 4, 5, 6, 7) различают слои (или оболочки), обозначаемые буквами 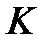 ,
, 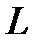 ,
, 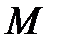 ,
,  ,
, 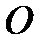 ,
,  ,
,  .
.
Как и энергия электрона в атоме, форма его облака тоже не может быть любой: она определяется величиной орбитального квантового числа  .Число
.Число  может принимать значения от 0 до
может принимать значения от 0 до 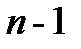 . Это значит, что при заданном значении главного квантового числа орбитальное квантовое число может принимать
. Это значит, что при заданном значении главного квантового числа орбитальное квантовое число может принимать  разных значений, иначе говоря, возможно
разных значений, иначе говоря, возможно  различных вариантов формы электронного облака. Как оказалось, энергия электрона зависит не только от
различных вариантов формы электронного облака. Как оказалось, энергия электрона зависит не только от  , но и от
, но и от  . По этой причине состояния электрона, отвечающие определенным значениям орбитального квантового числа, называют энергетическими подуровнями. Для электронов разных энергетических подуровней введены особые обозначения:
. По этой причине состояния электрона, отвечающие определенным значениям орбитального квантового числа, называют энергетическими подуровнями. Для электронов разных энергетических подуровней введены особые обозначения:  ,
, 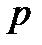 ,
, 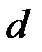 ,
,  , - которым отвечают значения
, - которым отвечают значения  , равные, соответственно, 0, 1, 2, 3. Самой низкой энергией при заданном главном квантовом числе обладают
, равные, соответственно, 0, 1, 2, 3. Самой низкой энергией при заданном главном квантовом числе обладают  -электроны, затем следуют
-электроны, затем следуют 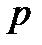 -электроны, затем -
-электроны, затем - 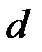 -и
-и  -электроны. Состояния электрона с заданными значениями главного и орбитальногоквантовых чисел записывают следующим образом:
-электроны. Состояния электрона с заданными значениями главного и орбитальногоквантовых чисел записывают следующим образом: 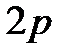 ,
,  ,
, 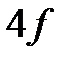 . Считается, что электронное облако
. Считается, что электронное облако  -электронов имеет сферическую форму, у
-электронов имеет сферическую форму, у 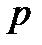 -электронов - гантелевидную, у
-электронов - гантелевидную, у 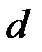 -и
-и  -электронов - еще более сложную. Форма электронного облака важна с точки зрения образования химических связей.
-электронов - еще более сложную. Форма электронного облака важна с точки зрения образования химических связей.
|
|
|
Ориентация электронного облака в пространстве квантуется магнитным квантовым числом 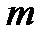 . Это квантовое число принимает все целочисленные значения в пределах от
. Это квантовое число принимает все целочисленные значения в пределах от 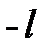 до
до  , т. е. при заданном
, т. е. при заданном  возможно (
возможно ( ) значение
) значение 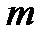 . С этим квантовым числом связывают магнитный момент, возникающий при орбитальном движении электрона в атоме. Состояния электрона с заданными значениями
. С этим квантовым числом связывают магнитный момент, возникающий при орбитальном движении электрона в атоме. Состояния электрона с заданными значениями 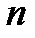 ,
,  и
и 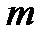 называют электронной орбиталъю. Для
называют электронной орбиталъю. Для  -электронов
-электронов  , следовательно, нет никакого квантования ориентации сферически симметричного электронного облака в пространстве. Для
, следовательно, нет никакого квантования ориентации сферически симметричного электронного облака в пространстве. Для 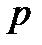 -электронов существует 3 различных ориентации облака, для
-электронов существует 3 различных ориентации облака, для 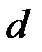 -электронов - 5, для
-электронов - 5, для  -электронов - 7. В многоэлектронных атомах энергия электрона зависит и от значения магнитного квантового числа.
-электронов - 7. В многоэлектронных атомах энергия электрона зависит и от значения магнитного квантового числа.
Наконец, спиновое квантовое число  принимает два значения (+1/2 и -1/2) и квантует вращение электрона вокруг собственной оси в двух взаимно противоположных направлениях.
принимает два значения (+1/2 и -1/2) и квантует вращение электрона вокруг собственной оси в двух взаимно противоположных направлениях.
В соответствии с принципом Паули, у многоэлектронного атома не может быть двух электронов, у которых одинаковыми были бы все четыре квантовых числа. Это значит, что любая электронная орбиталь может быть занята только двумя электронами, спиновые квантовые числа которых имеют противоположные знаки. Два таких электрона называются спаренными, но на некоторых орбиталях могут располагаться неспаренные электроны. Орбиталь с двумя спаренными электронами, обладающими противоположно направленными спинами, обозначается клеточкой с двумя взаимно противоположными стрелками  внутри нее.
внутри нее.
|
|
|
Порядок заполнения атомных орбиталей электронами подчиняется правилам Клечковского: заполнение происходит в порядке увеличения суммы  (1-е правило), а при одинаковых значениях этой суммы - в порядке увеличения главного квантового числа п (2-е правило). При постоянном значении
(1-е правило), а при одинаковых значениях этой суммы - в порядке увеличения главного квантового числа п (2-е правило). При постоянном значении  (т.е. в пределах подуровня) электроны заполняют максимально возможное число орбиталей (правило Хунда).Это означает, что стабильным будет такое состояние атома, при котором суммарное значение спина максимально (т.е. когда спины всех электронов, находящихся на данном подуровне, параллельны). В соответствии с этими правилами, заполнение электронами электронных орбиталей многоэлектронных атомов происходит в следующем порядке:
(т.е. в пределах подуровня) электроны заполняют максимально возможное число орбиталей (правило Хунда).Это означает, что стабильным будет такое состояние атома, при котором суммарное значение спина максимально (т.е. когда спины всех электронов, находящихся на данном подуровне, параллельны). В соответствии с этими правилами, заполнение электронами электронных орбиталей многоэлектронных атомов происходит в следующем порядке: 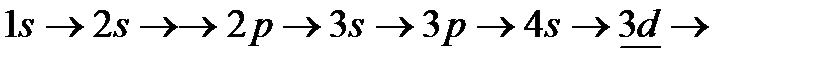
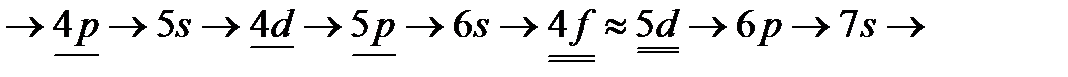
 . Одной и двумя чертами подчеркнуты случаи, когда в точном соответствии со 2-м правилом Клечковского заполняются сначала орбитали предыдущего уровня:
. Одной и двумя чертами подчеркнуты случаи, когда в точном соответствии со 2-м правилом Клечковского заполняются сначала орбитали предыдущего уровня:  , а не
, а не  ;
;  , а не
, а не 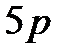 ;
;  , а не
, а не 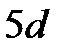 ;
;  , а не
, а не  , - хотя в двух последних случаях из-за близости энергий орбиталей
, - хотя в двух последних случаях из-за близости энергий орбиталей  и
и  , с одной стороны, и орбиталей
, с одной стороны, и орбиталей  и
и  ,с другой стороны, заполнение
,с другой стороны, заполнение  -орбиталей может приостанавливаться, и электронами могут заполняться
-орбиталей может приостанавливаться, и электронами могут заполняться  -орбитали. Это наблюдается, например, у гадолиния в ряду лантаноидов и для кюрия в ряду актинидов. Отчасти это объясняется тем, что наибольшей стабильностью, а значит, меньшей энергией, отличаются состояния с полностью или наполовину (гадолиний и кюрий) заполненными атомными орбиталями. Именно этим объясняется инертность благородных газов, у которых полностью заполненными являются не только внутренние, но и внешние (валентные) орбитали. Максимальное число электронов на энергетическом уровне равно 2
-орбитали. Это наблюдается, например, у гадолиния в ряду лантаноидов и для кюрия в ряду актинидов. Отчасти это объясняется тем, что наибольшей стабильностью, а значит, меньшей энергией, отличаются состояния с полностью или наполовину (гадолиний и кюрий) заполненными атомными орбиталями. Именно этим объясняется инертность благородных газов, у которых полностью заполненными являются не только внутренние, но и внешние (валентные) орбитали. Максимальное число электронов на энергетическом уровне равно 2 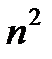 .
.
Электронная структура атома указывает последовательность заполнения атомных орбиталей по мере увеличения их энергии, а также число электронов на той или иной орбитали. Так, электронные структуры атомов азота, кислорода и фтора записываются, соответственно, следующим образом:  ,
,  и
и  . У всех этих трех атомов имеется по два электрона (указывается верхним индексом после обозначения орбитали) на орбитали
. У всех этих трех атомов имеется по два электрона (указывается верхним индексом после обозначения орбитали) на орбитали  и
и  , тогда как на орбитали
, тогда как на орбитали 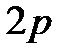 уазота 3 электрона, у кислорода - 4, а у фтора - 5. При ионизации (отрыв электрона от атома при сообщении последнему определенной энергии, называемой энергией ионизации) атом приобретает электронную конфигурацию своего предшественника, т.е. атома, расположенного в периодической системе на одну клеточку раньше. Энергия ионизации может быть определена при облучении атомов ускоренными в электрическом поле внешними электронами. При этом наименьшая разность потенциалов, при которой осуществляется ионизация атома, называется потенциалом ионизации. Поскольку образовавшийся в результате ионизации атома ион будет сильнее удерживать своим электростатическим полем оставшиеся электроны, потенциал каждой последующей ионизации всегда больше. В ряду элементов одной группы потенциал ионизации падает с ростом порядкового номера элемента, что обусловлено увеличением радиусов атомов и ионов, а следовательно, уменьшением силы электростатического притягивания внешних электронов к ядрам атомов. Элементы с полностью или наполовину заполненными электронными подуровнями обладают повышенными потенциалами ионизации.
уазота 3 электрона, у кислорода - 4, а у фтора - 5. При ионизации (отрыв электрона от атома при сообщении последнему определенной энергии, называемой энергией ионизации) атом приобретает электронную конфигурацию своего предшественника, т.е. атома, расположенного в периодической системе на одну клеточку раньше. Энергия ионизации может быть определена при облучении атомов ускоренными в электрическом поле внешними электронами. При этом наименьшая разность потенциалов, при которой осуществляется ионизация атома, называется потенциалом ионизации. Поскольку образовавшийся в результате ионизации атома ион будет сильнее удерживать своим электростатическим полем оставшиеся электроны, потенциал каждой последующей ионизации всегда больше. В ряду элементов одной группы потенциал ионизации падает с ростом порядкового номера элемента, что обусловлено увеличением радиусов атомов и ионов, а следовательно, уменьшением силы электростатического притягивания внешних электронов к ядрам атомов. Элементы с полностью или наполовину заполненными электронными подуровнями обладают повышенными потенциалами ионизации.
|
|
|
Рассмотрим примеры решения типовых задач по данному разделу.
Пример 1. Записать электронную формулу атома хлора.
Решение. Атом хлора занимает 17-ю клеточку таблицы Менделеева, значит, он имеет 17 электронов. Они распределяются следующим образом по орбиталям:  .
.
Ответ: Электронная формула атома хлора  .
.
Пример 2. Написать электронную формулу иона  . Какому элементу она соответствует?
. Какому элементу она соответствует?
Решение. Порядковый номер атома кислорода - 8. Ему отвечает электронная конфигурация  . У иона
. У иона 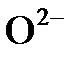 на 2 электрона больше, чем у атома кислорода. Значит, электронная конфигурация иона
на 2 электрона больше, чем у атома кислорода. Значит, электронная конфигурация иона 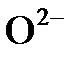 будет следующей:
будет следующей:  , эта конфигурация соответствует заполненной конфигурации атома
, эта конфигурация соответствует заполненной конфигурации атома  .
.
Ответ: Электронная формула иона 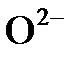 -
-  , она соответствует электронной конфигурации атома
, она соответствует электронной конфигурации атома  .
.
Пример 3. Определить максимально возможное число электронов на  уровне.
уровне.
Решение. Обозначению  уровень отвечает значение главного квантового числа
уровень отвечает значение главного квантового числа  3. При данном значении
3. При данном значении  возможно 3 значения орбитального квантового числа
возможно 3 значения орбитального квантового числа  : 0, 1 и 2. Им отвечают 1, 3 и 5 орбиталей, соответственно, т.е. в совокупности 9 орбиталей. На каждой из них, в соответствии с принципом Паули, могут размещаться по 2 электрона, следовательно, всего на
: 0, 1 и 2. Им отвечают 1, 3 и 5 орбиталей, соответственно, т.е. в совокупности 9 орбиталей. На каждой из них, в соответствии с принципом Паули, могут размещаться по 2 электрона, следовательно, всего на 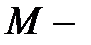 уровне может разместиться
уровне может разместиться 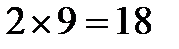 электронов. В свою очередь,
электронов. В свою очередь, 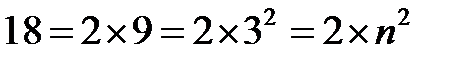 .
.
Ответ: Максимальное число электронов, которое может разместиться на 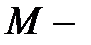 уровне, равно 18 (или
уровне, равно 18 (или 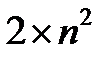 ).
).
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 853; Нарушение авторских прав?; Мы поможем в написании вашей работы!