
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы и способы выражения их концентрации
|
|
|
|
Задачи
7.1. Найти значение константы скорости реакции 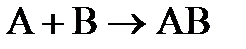 , если при концентрациях веществ А и В, равных соответственно 0,05 и 0,01 моль/л, скорость реакции равна
, если при концентрациях веществ А и В, равных соответственно 0,05 и 0,01 моль/л, скорость реакции равна  моль/(л´мин).
моль/(л´мин).
7.2. Во сколько раз изменится скорость реакции 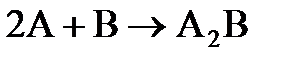 , если концентрацию вещества А увеличить в два раза, а концентрацию вещества В уменьшить в два раза?
, если концентрацию вещества А увеличить в два раза, а концентрацию вещества В уменьшить в два раза?
7.3. В два сосуда одной и той же вместимости введены: в первый - 1 моль газа А и 2 моля газа В, во второй - 2 моля газа А и 1 моль газа В. Температура в обоих сосудах одинакова. Будет ли различаться скорость реакции между газами А и В в этих сосудах, если скорость реакции выражается: а) уравнением 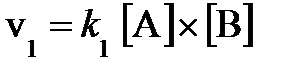 ; б) уравнением
; б) уравнением 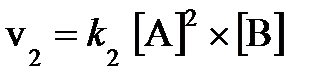 ?
?
7.4. В системе 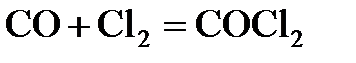 концентрацию увеличили от 0,03 до 0,12 моль/л, а концентрацию хлора - от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
концентрацию увеличили от 0,03 до 0,12 моль/л, а концентрацию хлора - от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
7.5. Две реакции протекают при 25°С с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2,0; второй - 2,5. Найти отношение скоростей этих реакций при 95°С.
7.6. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возрастает в 15,6 раза?
7.7. Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на 25 градусов?
7.8. При некоторой температуре равновесие в системе 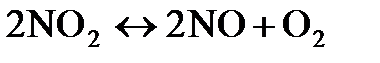 установилось при следующих концентрациях:
установилось при следующих концентрациях: 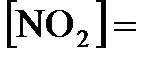 0,006 моль/л;
0,006 моль/л; 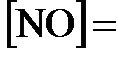 0,024 моль/л. Найти константу равновесия реакции и исходную концентрацию
0,024 моль/л. Найти константу равновесия реакции и исходную концентрацию  .
.
7.9. Константа равновесия реакции 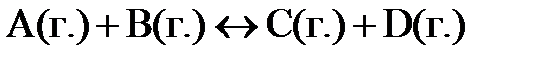 равна единице. Сколько процентов вещества А подвергнется превращению, если смешать 3 моля вещества А и 5 молей вещества В?
равна единице. Сколько процентов вещества А подвергнется превращению, если смешать 3 моля вещества А и 5 молей вещества В?
7.10. После смешивания газов А и В в системе  устанавливается равновесие при следующих концентрациях:
устанавливается равновесие при следующих концентрациях: 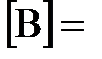 0,05 моль/л;
0,05 моль/л;  0,02 моль/л. Константа равновесия реакции равна
0,02 моль/л. Константа равновесия реакции равна 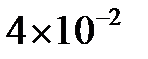 . Найти исходные концентрации веществ А и В.
. Найти исходные концентрации веществ А и В.
|
|
|
7.11. В замкнутом сосуде протекает реакция 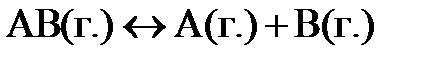 . Константа равновесия реакции равна 0,04; а равновесная концентрация вещества В составляет 0,02 моль/л. Найти начальную концентрацию вещества АВ. Сколько процентов вещества АВ разложилось?
. Константа равновесия реакции равна 0,04; а равновесная концентрация вещества В составляет 0,02 моль/л. Найти начальную концентрацию вещества АВ. Сколько процентов вещества АВ разложилось?
7.12. Константа равновесия реакции 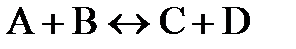 равна единице. Начальная концентрация
равна единице. Начальная концентрация  0,02 моль/л. Сколько процентов вещества А подвергается превращению, если начальные концентрации
0,02 моль/л. Сколько процентов вещества А подвергается превращению, если начальные концентрации 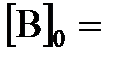 0,02; 0,1 и 0,2 моль/л?
0,02; 0,1 и 0,2 моль/л?
7.13. Как зависит скорость химической реакции от концентрации реагирующих веществ? Написать математические выражения для скоростей реакций, протекающих по уравнениям:
а) 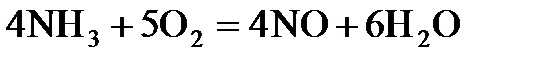 ; б)
; б) 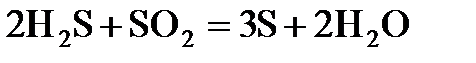 ; в)
; в) 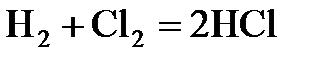 .
.
7.14. Как изменится скорость реакции 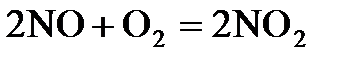 , если концентрации исходных веществ увеличить в 4 раза?
, если концентрации исходных веществ увеличить в 4 раза?
7.15. Как изменится скорость реакции, протекающей по уравнению 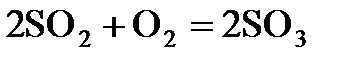 :
:
а) если увеличить концентрацию кислорода в 2 раза?
б) если, оставив концентрацию кислорода начальной, увеличить втрое концентрацию 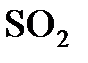 ?
?
7.16. Во сколько раз необходимо увеличить для реакции 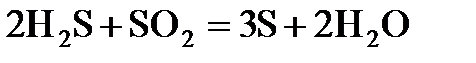 концентрацию сероводорода или оксида серы (IV), чтобы в обоих случаях скорость реакции возросла в 9 раз?
концентрацию сероводорода или оксида серы (IV), чтобы в обоих случаях скорость реакции возросла в 9 раз?
7.17. Реакция между веществами А и В протекает по уравнению 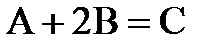 . Начальная концентрация вещества А равна 0,3 моль/л, а вещества В - 0,5 моль/л. Константа скорости данной реакции 0,4. Вычислить начальную скорость реакции и скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшилась на 0,1 моль/л.
. Начальная концентрация вещества А равна 0,3 моль/л, а вещества В - 0,5 моль/л. Константа скорости данной реакции 0,4. Вычислить начальную скорость реакции и скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшилась на 0,1 моль/л.
7.18. Две реакции между простыми веществами протекают с такой скоростью, что за одну минуту образуется в первой реакции 6 г сероводорода, а во второй реакции 20 г йодоводрода. Какая из этих реакций протекает с большей скоростью?
7.19. На сколько градусов надо повысить температуру, чтобы скорость реакции увеличилась в 64 раза, если температурный коэффициент реакции равен двум?
|
|
|
7.20. Скорость химической реакции при 40°С равна 1 моль/(л´с). Вычислить скорость этой реакции при 80°С, если температурный коэффициент реакции равен четырем.
Раствором называется однородная (гомогенная) система, состоящая из двух или более компонентов, относительные концентрации которых могут изменяться в широких пределах. Наиболее распространенными и важными для практического использования являются жидкие растворы. В случае растворов газов или твердых веществ жидкость является растворителем, а газы или твердые вещества - растворенными веществами. Отношение количества или массы растворенного вещества (или растворителя) к объему или массе раствора называется концентрацией растворенного вещества (или растворителя) в растворе. Наиболее употребительными понятиями, которые служат для выражения концентрации раствора, являются:
1. Молярная концентрация (или молярностъ) 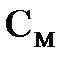 - отношение имеющегося в растворе количества растворенного вещества, выраженного в молях, к объему раствора.
- отношение имеющегося в растворе количества растворенного вещества, выраженного в молях, к объему раствора. 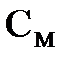 измеряется в моль/л. Раствор, содержащий в 1 литре п молей растворенного вещества, называется
измеряется в моль/л. Раствор, содержащий в 1 литре п молей растворенного вещества, называется 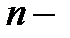 молярным и обозначается как
молярным и обозначается как 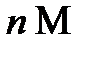 раствор (например, 2М раствор
раствор (например, 2М раствор 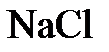 ).
).
2. Эквивалентная (или нормальная) концентрация 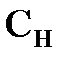 - отношение числа эквивалентов растворенного вещества к объему раствора. Раствор, в 1 литре которого имеется п эквивалентов растворенного вещества, называется
- отношение числа эквивалентов растворенного вещества к объему раствора. Раствор, в 1 литре которого имеется п эквивалентов растворенного вещества, называется 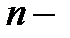 нормальным (например, запись «2 н. раствор
нормальным (например, запись «2 н. раствор 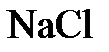 » означает, что
» означает, что 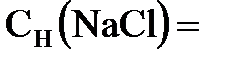 2 моль/л).
2 моль/л).
3. Моляльная концентрация (или моляльностъ) т - отношение числа молей растворенного вещества к массе растворителя, измеряется в моль/кг. Запись «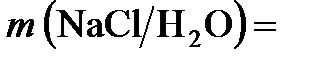 2 моль/кг» означает, что в 1 кг
2 моль/кг» означает, что в 1 кг 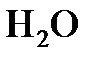 растворено 2 моля
растворено 2 моля 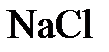 .
.
4. Массовая концентрация - отношение массы растворенного вещества (или растворителя) к объему раствора, измеряется в кг/м3, г/см3, г/л и т.п. единицах,
5. Молярная, массовая или объемная доли - отношение числа молей компонента раствора, его массы или объема к общему числу молей, к общей массе или к общему объему раствора, соответственно. Единицами измерения являются либо доли единицы, либо проценты, а также промилле (тысячная часть %) и миллионные и миллиардные доли (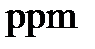 и
и 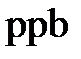 -
- 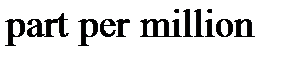 и
и 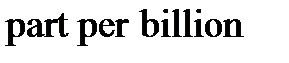 , т.е. 1 часть на миллион или миллиард).
, т.е. 1 часть на миллион или миллиард).
Многие физические свойства жидкого раствора отличаются от таковых для растворителя. К числу таких свойств относится и плотность. С ростом массовой доли растворенного вещества плотность получаемого раствора увеличивается. Для одного и того же растворителя величина относительного увеличения плотности зависит от природы растворенного вещества. Данные о плотности наиболее распространенных растворов солей, кислот и оснований при комнатной температуре имеются в справочной литературе по химии.
|
|
|
Если в качестве реагентов выступают растворы, закон эквивалентов сводится к соотношению
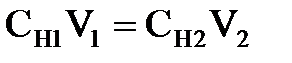 ,
,
в котором 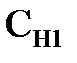 и
и 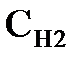 - эквивалентные концентрации (нормальности), а
- эквивалентные концентрации (нормальности), а 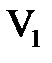 и
и 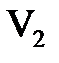 - объемы растворов веществ, принимающих участие в реакции. На основе закона эквивалентов можно определять эквивалентную концентрацию одного из участвующих в реакции веществ, если известна названная характеристика другого реагента.
- объемы растворов веществ, принимающих участие в реакции. На основе закона эквивалентов можно определять эквивалентную концентрацию одного из участвующих в реакции веществ, если известна названная характеристика другого реагента.
Теперь рассмотрим примеры решения задач по данному разделу.
Пример 1. Найти массовую долю азотной кислоты в растворе, в 1 л которого содержится 224 г  (
( 1,12 г/мл).
1,12 г/мл).
Решение. Массовая доля растворенного вещества 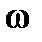 равна отношению его массы к общей массе раствора. Масса кислоты
равна отношению его массы к общей массе раствора. Масса кислоты 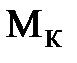 известна, остается найти массу раствора
известна, остается найти массу раствора 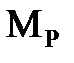 . Она равна произведению плотности раствора на его объем:
. Она равна произведению плотности раствора на его объем:
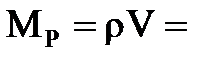 1,12г/мл´1л = 1120 г. Следовательно,
1,12г/мл´1л = 1120 г. Следовательно,
 20%.
20%.
Ответ: Массовая доля азотной кислоты в растворе  .
.
Пример 2. Какой объем воды надо прибавить к 100 мл 20%-ного (по массе) раствора 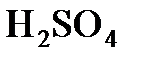 (
( 1,14 г/мл), чтобы получить 5%-ный раствор?
1,14 г/мл), чтобы получить 5%-ный раствор?
Решение. Масса 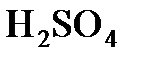 в обоих растворах одна и та же, различается лишь масса воды. Найдем массу кислоты. Она составляет 20% от массы раствора
в обоих растворах одна и та же, различается лишь масса воды. Найдем массу кислоты. Она составляет 20% от массы раствора 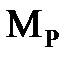 , т.е.
, т.е. 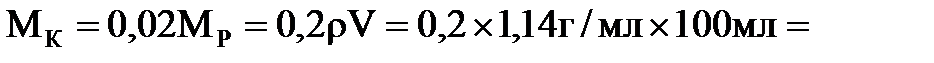 22,8 г. Масса воды в этом растворе равна
22,8 г. Масса воды в этом растворе равна 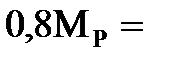 91,2 г.
91,2 г.
Теперь определим массу 5%-ного раствора. Для этого составим пропорцию:
22,8 г составляют 5% массы раствора, а
х г - 100%,
откуда 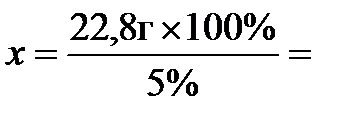 456 г. Вычтя из этой величины массу кислоты (22,8 г) и массу воды в концентрированном растворе (91,2 г), находим массу воды
456 г. Вычтя из этой величины массу кислоты (22,8 г) и массу воды в концентрированном растворе (91,2 г), находим массу воды  , которую необходимо прибавить к концентрированному раствору:
, которую необходимо прибавить к концентрированному раствору:
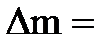 456 г - 22,8 г - 91, 2 г = 342 г. Откуда дополнительный объем воды:
456 г - 22,8 г - 91, 2 г = 342 г. Откуда дополнительный объем воды:
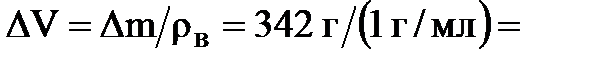 342 мл (
342 мл (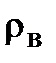 - плотность воды).
- плотность воды).
|
|
|
Ответ: Дополнительный объем воды - 342 мл.
Пример 3. Какой объем 0,1 М раствора 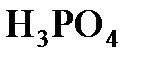 можно приготовить из 75 мл 0,75 н. раствора?
можно приготовить из 75 мл 0,75 н. раствора?
Решение. Определим сначала молярную концентрацию 0,75 н. раствора кислоты. В основе определения нормальной концентрации лежит количество эквивалентов растворенного вещества, которое равно отношению его массы к эквивалентной массе. Поскольку мы имеем дело с трехосновной кислотой, то ее эквивалентная масса в 3 раза меньше молярной массы. Это означает, что нормальная концентрация численно в 3 раза выше молярной, следовательно, 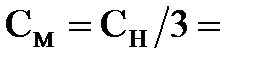 0,75/3 моль/л = 0,25 моль/л. Чтобы из 0,25 М раствора получить 0,1 М раствор, надо объем увеличить в 0,25/0,1 = 2,5 раза. Таким образом, искомый объем будет равен 75 мл´2,5 = 187,5 мл.
0,75/3 моль/л = 0,25 моль/л. Чтобы из 0,25 М раствора получить 0,1 М раствор, надо объем увеличить в 0,25/0,1 = 2,5 раза. Таким образом, искомый объем будет равен 75 мл´2,5 = 187,5 мл.
Ответ: Объем 0,1 М раствора равен 187,5 мл.
Пример 4. В какой массе воды нужно растворить 25 г 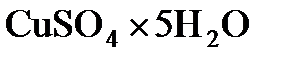 , чтобы получить 8%-ный (по массе) раствор
, чтобы получить 8%-ный (по массе) раствор 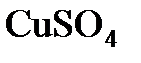 ?
?
Решение. Найдем массу сухого сульфата и кристаллизационной воды в пятиводном сульфате меди. Мольная масса кристаллогидрата равна 249,7 г/моль, мольная масса безводного сульфата равна 159,6 г/моль. Для нахождения массы безводного сульфата меди в кристаллогидрате составим пропорцию:
25 г 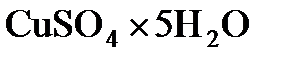 отвечают мольной массе 249,7 г/моль,
отвечают мольной массе 249,7 г/моль,
а х г 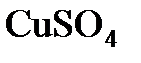 - 159,6 г/моль,
- 159,6 г/моль,
откуда 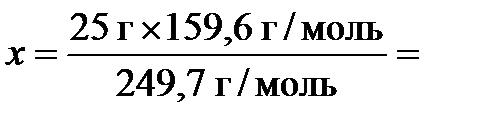 15,98 г. Тогда масса воды в кристаллогидрате будет равна 25 г - 15,98 г = 9,02 г.
15,98 г. Тогда масса воды в кристаллогидрате будет равна 25 г - 15,98 г = 9,02 г.
Масса воды в 8%-ном (по массе) растворе 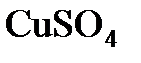 может быть найдена из пропорции:
может быть найдена из пропорции:
8 % соответствуют 15,98 г,
а 92% - у г,
откуда 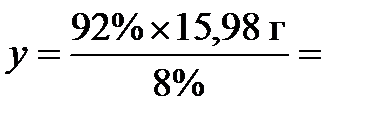 183,77 г. Но в кристаллогидрате уже есть 9,02 г воды, следовательно, нужно взять (183,77 г - 9,02 г) = 174,75 г воды для приготовления нужного раствора.
183,77 г. Но в кристаллогидрате уже есть 9,02 г воды, следовательно, нужно взять (183,77 г - 9,02 г) = 174,75 г воды для приготовления нужного раствора.
Ответ: Требуемая масса воды 174,75 г.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 807; Нарушение авторских прав?; Мы поможем в написании вашей работы!