
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 9. Хімічна рівновага
|
|
|
|
Тема 8. Хімічна кінетика
Тема 7. Енергетика і напрямленість хімічних процесів
Теплові ефекти хімічних реакцій. Закон Гесса. Зміна внутрішньої енергії системи. Ентальпія. Поняття про ентропію. Ізобарно-ізотермічний потенціал (енергія Гіббса).
Роль ентальпійного і ентропійного факторів в напрямленості процесів при різних умовах. Методика використання термодинамічних розрахунків для оцінки можливості протікання реакцій.
Швидкість хімічних реакцій. Миттєва і середня швидкості хімічних реакцій. Фактори, що впливають на швидкість хімічних реакцій. Залежність швидкості реакцій від концентрації реагуючих речовин. Закон діючих мас, його застосування для гомогенних та гетерогенних систем. Константа швидкості реакції. Вплив фактора величини площини поверхні на швидкість реакцій в гетерогенному середовищі. Залежність швидкості реакції від температури; температурний коефіцієнт. Поняття про активні молекули і енергію активації процесу.
Простий, іонний і радикальний механізм хімічних реакцій. Вільні радикали. Поняття про ланцюгові реакції. Роботи академіка М. М. Семенова.
Каталіз. Вплив каталізаторів на швидкість реакцій. Види каталізу. Особливості ферментів як каталізаторів. Використання каталізу в промисловості. Роль каталізаторів в біологічних системах.
Необоротні і оборотні реакції. Умови оборотності і необоротності хімічних процесів. Хімічна рівновага. Константа хімічної рівноваги. Принцип Ле Шатальє. Зміщення хімічної рівноваги при зміні різних факторів.
Значення вчення про швидкість хімічних реакцій і хімічної рівноваги для керування хімічних процесів, для біологічних систем.
Тести дo модуля 2. “Хімічні процеси”
|
|
|
2.1. Виберіть твердження щодо назви процесу, якщо при розчиненні кислоти у воді температура розчину зросла:
A) адіабатичний;
B) ізотермічний;
C) ендотермічний;
D) екзотермічний;
E) ланцюговий.
2.2. Розрахуйте тепловий ефект горіння 11,2 дм3 метану (н.у.), використовуючи термохімічне рівняння: CH4 (г) + 2O2 (г) → CO2 (г) + 2H2O(p.) + 890 кДж
A) 890 кДж;
B) 445 кДж;
C) 222 кДж;
D) 1780 кДж;
E) 1200 кДж.
2.3. Виберіть твердження щодо теплового ефекту реакції нейтралізації 1 молю HI і 1 молю HNO3:
A) однаковий позитивний;
B) для HI більший;
C) для HI менший;
D) однаковий негативний;
E) немає.
2.4. Розрахуйте тепловий ефект реакції, якщо при горінні 10,8 г алюмінію в кисні виділяється 82 кДж теплоти:
A) 164 кДж;
B) 820 кДж;
C) 246 кДж;
D) 700 кДж;
E) 800 кДж.
2.5. Виберіть правильне твердження: «тепловий ефект хімічної реакції визначається...»:
A) температурою протікання реакції;
B) кількістю стадій реакції;
C) часом протікання реакції;
D) початковим та кінцевим станом системи;
E) тиском.
2.6. Визначте без розрахунків, при проведенні якої з реакцій ентропія системи збільшиться:
A) 2CO + O2 → 2CO2 ;
B) C4H10 → C2H6 + C2H4 ;
C) CH4 + 2O2 → CO2 + 2H2O;
D) NaOH + HCl → NaCl + H2O;
E) Cl2 + H2O → HCl + HClO.
2.7. Визначте масу вугілля, що згоріло, якщо виділилося 1206 кДж теплоти. Термохімічне рівняння цієї реакції: С (тв) + О2(г) = СО2(г) + 402 кДж
A) 20 г;
B) 24 г;
C) 36 г;
D) 48 г;
E) 50 г.
2.8. Визначте без розрахунків, при проведенні яких реакцій ентропія системи зменшиться:
A) n CH2 = CH2 → (-CH2 - CH2 -)n;
B) KOH + HNO3 → KNO3 + H2O;
C) 2CO + O2 → 2CO2;
D) AgNO3 + NaCl → AgCl ¯+ NaNO3;
E) H2 + F2 → 2HF.
2.9. Визначте масу кальцію, що прореагував з киснем, якщо виділилося 317,7кДж теплоти. Термохімічне рівняння цієї реакції:
Ca(т) + ½O2 (г) → CaO (т) + 635.5 кДж
A) 40 г;
B) 45 г;
C) 100 г;
D) 20 г;
E) 25 г.
2.10. Визначте тепловий ефект реакції Cr2O3 (т) + Al (т) → Al2O3(т) + 2Сr(т) при 298 К, якщо  Нутв.(Al2O3(т)) = - 1676 кДж/моль,
Нутв.(Al2O3(т)) = - 1676 кДж/моль,
D Нутв.(Cr2O3(т)) = - 1141 кДж/моль:
A) + 600 кДж;
B) - 600 кДж;
C) - 535 кДж;
D) + 535 кДж;
E) 700 кДж.
|
|
|
2.11. Визначте тепловий ефект реакції SO2(г) + ½O2 (г) → SO3(р) при 298 К і постійному тиску, якщо DНутв.(SO2(г)) = - 297 кДж/моль;
DНутв.(SO3(р)) = 396 кДж/моль:
A) 198 кДж;
B) -198 кДж;
C) -99 кДж;
D) + 99 кДж;
E) 150 кДж.
2.12. Визначте тепловий ефект реакції NH3 (г) + HCl (г) → NH4 Cl (тв) при 298 К та постійному тиску, якщо DНутв.(NH3 (г)) = - 46,2кДж/моль;
Нутв.(HCl (г)) = - 91,8 кДж/моль; DНутв.(NH4 Cl (тв)) = - 314,2 кДж/моль;
A) -176,2 кДж;
B) -352,4 кДж;
C) 400 кДж;
D) 176,2 кДж;
E) 352,4 кДж.
2.13. Розрахуйте стандартну ентальпію реакції NO(г) + ½O2(г) → NO2(г),
якщо DНутв.(NO(г)) = 90,2 кДж/моль; DНутв.(NO2(г)) = -33 кДж/моль:
A) + 57,2 кДж;
B) -57,2 кДж;
C) -114,4 кДж;
D) + 114,4 кДж;
E) 150 кДж.
2.14. Розрахуйте стандартну ентальпію реакції
H2S(г) + 3/2O2(г) → SO2 (г) + H2O (г), якщо DНутв.(H2S(г)) = - 21 кДж/моль; DНутв.(SO2(г)) = - 297 кДж/моль; DНутв.(H2O(г)) = - 242 кДж/моль:
A) + 518 кДж;
B) + 625 кДж;
C) -518 кДж;
D) -625 кДж;
E) -751 кДж.
2.15. Розрахуйте ентальпію утворення (DНутв) FeS, якщо при взаємодії 5,6 г заліза з сіркою виділилося 0,95 кДж теплоти:
A) - 9,5 кДж/моль;
B) -95 кДж/моль;
C) + 95 кДж/моль;
D) - 9,5 кДж/моль;
E) 950 кДж/моль.
2.16. Виберіть з наведених реакцій гетерогенну:
A) 2CO + O2 → 2CO2;
B) Na + H2O → NaOH + H2;
C) H2 + F2 → 2HF;
D) H + + OH- → H2O;
E) CH2 = CH2 + H2 → CH3 – CH3.
2.17. Виберіть назву основного закону термохімії: «тепловий ефект хімічної реакції залежить лише від початкового та кінцевого станів реагентів і не залежить від шляху її перебігу»:
A) закон Фарадея;
B) закон Бугера – Ламберта – Бера;
C) другий закон термодинаміки;
D) закон Геса;
E) закон Дальтона.
2.18. Виберіть вид системи, до якої відноситься Н2SO4:
A) гетерогенна, двофазна, однокомпонентна;
B) гетерогенна, двокомпонентна;
C) гетерогенна, двофазна, двокомпонентна;
D) гомогенна, однокомпонентна;
E) гетерогенна, двокомпонентна, трифазна.
2.19. Виберіть вірне твердження: взаємодія негашеного вапна (СаО) з водою є реакцією:
A) екзотермічною, заміщення;
B) ендотермічною, приєднання;
C) екзотермічною, відщеплення;
D) екзотермічною, приєднання;
E) ендотермічною, обміну.
2.20. Обчисліть кількість теплоти (кДж) при утворенні 22,4 дм3 НСІ (н.у.) в результаті реакції: Н2 (г) + СІ2 (г) → 2 НСІ(г) + 192 кДж
A) 384 кДж;
B) 192 кДж;
C) 91 кДж;
D) 475 кДж;
E) 566 кДж.
2.21. Визначте стандартну ентальпію СuO, якщо при відновленні 1 молю СuO карбоном з утворенням СО поглинається 52 кДж
(D Н0 утв.(CO(г)) = -110кДж/моль):
|
|
|
A) - 102 кДж/моль;
B) +102 кДж/моль;
C) - 162 кДж/моль;
D) + 162 кДж/моль;
E) - 58 кДж/моль.
2.22. Виберіть чинник, зміна якого є критерієм напрямку перебігу самочинного процесу, що відбувається в ізольованій системі:
A) енергія Гіббса;
B) ентропія;
C) енергія Гельмгольца;
D) ентальпія;
E) стандартний редокспотенціал.
2.23. Виберіть чинник, який не впливає на константу швидкості хімічної реакції:
A) температура;
B) природа розчинника;
C) концентрація реагуючих сполук;
D) природа реагуючих речовин;
E) тиск.
2.24. Виберіть назву закону хімічної кінетики «швидкість хімічної реакції пропорційна добутку молярних концентрацій реагентів»:
A) закон розведення;
B) закон діючих мас;
C) другий закон термодинаміки;
D) закон об’ємних відношень;
E) закон кратних відношень.
2.25. Виберіть чинник, за величиною якого порівнюють швидкості хімічних реакцій рівних порядків:
A) концентрація вихідних речовин;
B) концентрація продуктів реакції;
C) час перебігу реакції;
D) швидкість хімічної реакції;
E) константа швидкості хімічної реакції.
2.26. Визначте, у скільки разів зросте швидкість реакції: 2С2Н2 + 5О2 → 4СО2 + 2Н2О, при постійному об’ємі і збільшенні концентрації О2 в 2 рази:
A) в 2 рази;
B) в 4 рази;
C) в 8 разів;
D) в 16 разів;
E) в 32 рази.
2.27. Вкажіть, який з наведених записів за законом діючих мас виражає швидкість хімічного процесу 2Н2(г) + О2(г) → 2Н2О(г):
A) 
B) 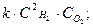
C) 
D) 
E) 
2.28. Виберіть твердження, яке пояснює підвищення швидкості реакції у присутності каталізатора:
A) збільшується загальна кількість зіткнень молекул;
B) підвищується швидкість руху молекул;
C) зменшується енергія активації;
D) збільшується енергія активації;
E) підвищується загальна енергія системи.
2.29. Визначте початкову концентрацію кисню, якщо через деякий час після початку реакції 4НСІ + О2 → 2Н2О + 2СІ2 концентрації речовин були [HCl] = 0,75моль/л; [O2] = 0,42 моль/л; [Cl2] = 0,20 моль/л:
A) 0,84 моль/л;
B) 0,62 моль/л;
C) 0,52 моль/л;
D) 0,72 моль/л;
E) 0,82 моль/л.
2.30. Обчисліть, у скільки разів підвищилась швидкість прямої реакції, якщо у системі СО2 + Сl2 → СОСl2 концентрацію СО підвищили з 0,03 до 0,12 моль/л, а концентрацію Сl2 від 0,02 до 0,06 моль/л:
|
|
|
A) в 10 разів;
B) в 8 разів;
C) в 2 рази;
D) в 12 разів;
E) в 14 разів.
2.31. Розрахуйте константу рівноваги оборотної реакції H2 + J2 «2HJ, якщо при
600 оС константа швидкості прямої реакції 0,25, а константа швидкості зворотної реакції 0,005:
A) 10;
B) 50;
C) 25;
D) 100;
E) 200.
2.32. Дві реакції протікають з однаковою швидкістю при 20о С. Температурний коефіцієнт швидкості першої реакції 2, другої – 3. Визначте відношення швидкостей реакцій при 50о С:
A) 2/3;
B) 3/2;
C) 8/2725;
D) 27/8;
E) 16/9.
2.33. Виберіть чинники, зміна яких призведе до зміни константи рівноваги хімічної реакції:
A) зміна тиску;
B) зміна об’єму системи;
C) зміна каталізатору;
D) зміна температури;
E) зміна концентрацій реагуючих речовин.
2.34. Визначте, як змістити рівновагу ендотермічної реакції дегідрування вуглеводнів C4H10 (г)«C4H6 (г) + 2H2 (г) у бік утворення C4H6. (Відповідь дайте у вигляді А + В + С…..):
A) зменшити тиск;
B) підвищити тиск;
C) зменшити температуру;
D) зменшити концентрацію H2;
E) ввести каталізатор.
2.35. Визначте, як підвищиться швидкість реакції 2CO (г) + O2 (г) → 2CO2(г) при збільшенні тиску в системі у 3 рази:
A) в 27 разів;
B) в 9 разів;
C) в 3 рази;
D) в 30 разів;
E) в 20 разів.
2.36. Обчисліть температурний коефіцієнт швидкості реакції, якщо при нагріванні реакційної суміші від 30оС до 60 оС швидкість реакції збільшилась у 27 разів:
A) 4;
B) 2;
C) 3;
D) 6;
E) 1.
2.37. Обчисліть зміну швидкості прямої та зворотної реакцій
CO(г) + 2H2 (г) «CH3OH(г) при збільшенні тиску у 3 рази:
A) прямої збільшиться у 27 разів, зворотної не зміниться;
B) прямої збільшиться у 9 разів, зворотної збільшиться у 9 разів;
C) прямої збільшиться у 27 разів, зворотної збільшиться у 3 рази;
D) прямої збільшиться у 9 разів, зворотної збільшиться у 27 разів;
E) прямої збільшиться у 3 рази, зворотної збільшиться у 9 разів.
2.38. Визначте основну відмінність ферментів від небіологічних каталізаторів:
A) висока гомогенність;
B) мала селективність;
C) висока універсальність;
D) висока специфічність;
E) висока селективність.
2.39. Вкажіть, згідно з принципом Ле Шательє, який з наведених процесів повинен проводитися при підвищеному тиску:
A) 4Al(т) + 3O2 (г) «2Al2O3(т);
B) 2 NO(г) + O2 (г) «2NO2(г);
C) H2CO3 (р) «CO2(г) + 2H2O(р);
D) (CuOH)2CO3 (т) «2CuO(т) + CO2(г) + 2H2O(г);
E) N2(г) + 3H2 (г) «2NH3(г).
2.40. Вкажіть, для яких процесів підвищення температури збільшує вихід реакції:
A) ендотермічного;
B) екзотермічного;
C) адіабатичного;
D) ізольованого;
E) ізохорного.
2.41. Виберіть чинники, що змінюють енергію активації реакції:
A) підвищення температури;
B) підвищення тиску;
C) збільшення концентрації;
D) додавання каталізатора;
E) зміна розчинника.
2.42. Розрахуйте зміну швидкості реакції при підвищенні температури з 50оС до 90оС, якщо температурний коефіцієнт швидкості реакції дорівнює 2:
A) збільшиться у 4 рази;
B) збільшиться у 8 разів;
C) збільшиться у 16 разів;
D) збільшиться у 32 рази;
E) зменшиться у 32 рази.
2.43. Розрахуйте зміну температури реакції, необхідну для підвищення швидкості ре- акції у 27 разів, якщо температурний коефіцієнт швидкості реакції дорівнює 3:
A) на 10ºС;
B) на 20ºС;
C) на 30ºС;
D) на 40ºС;
E) на 50ºС.
2.44. Вкажіть вираз кінетичного рівняння для реакції
(CuOH)2CO3 (т) → 2CuO(т) + CO2(г) + 2H2O(г):
A) V = k[(CuOH)2CO3];
B) V = k;
C) V = k [CO2];
D) V = k[CuO]2;
E) V = k [H2O]2.
2.45. Визначте механізм дії ферментів у біохімічних реакціях:
A) підвищують енергію активації;
B) знижують енергію активації;
C) інгібірують реакцію;
D) змінюють константу швидкості реакції;
E) змінюють порядок реакції.
2.46. Обчисліть зміну швидкості реакції 4Al(т) + 3O2 (г) → 2Al2O3(т) при збільшенні концентрації O2 у 3 рази:
A) збільшиться у 9 разів;
B) збільшиться у 27 разів;
C) збільшиться у 18 разів;
D) збільшиться у 81 раз;
E) зменшиться у 27 разів.
2.47. Виберіть рівняння оборотної реакції, яка найбільш чутлива до зміни температури:
A) CH4 (г) + 2O2 (г) ↔ CO2 (г) + 2H2O(p) + 890 кДж;
B) COCl2 (г) ↔CO(г) + Cl2(г) - 108 кДж;
C) 2CO(г) ↔ C(т) + CO2(г) + 164 кДж;
D) 2SO3(г) ↔ 2SO2(г) + O2(г) - 198 кДж.
2.48. Виберіть чинники, що впливають на швидкість хімічної реакції у гетерогенних системах тверда речовина - рідина:
A) температура;
B) тиск;
C) ступінь подрібнення твердої речовини;
D) концентрація.
2.49. Виберіть рівняння оборотних реакцій, які найбільш чутливі до зміни тиску:
A) 4Cr(т) + 3O2 (г) «2Cr2O3(т);
B) 2 CO(г) + O2 (г) «2CO2(г);
C) H2SO3 (р) «SO2(г) + 2H2O(р);
D) (CuOH)2CO3 (т) «2CuO(т) + CO2(г) + 2H2O(г);
E) N2(г) + 3H2 (г) «2NH3(г).
2.50. Визначте напрямок зміщення рівноваги реакції: 2 CO(г) + O2 (г) «2CO2(г), при відповідній зміні умов:
A) зміщується в бік зворотної реакції при збільшенні тиску;
B) зміщується в бік зворотної реакції при зменшенні тиску;
C) зміщується в бік зворотної реакції при підвищенні концентрації O2;
D) зміщується в бік прямої реакції при підвищенні концентрації O2;
E) не зміщується при зміні тиску.
2.51. Розрахуйте початкову швидкість реакції між NO та O2 при початкових концентраціях [NO] = 0,2 моль/дм3, [O2] = 0,5 моль/дм3 , константа швидкості реакції 0,5:
A) 0,050;
B) 0,010;
C) 0,025;
D) 0,020;
E) 0,075.
ЗМІСТОВИЙ МОДУЛЬ 3.
РОЗЧИНИ І РЕАКЦІЇ В ВОДНИХ РОЗЧИНАХ
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 999; Нарушение авторских прав?; Мы поможем в написании вашей работы!